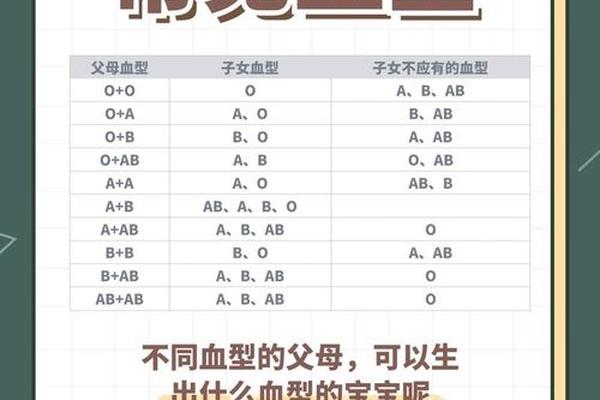
ABO血型系统是人类最早发现的血液分类体系,其亚型研究始终是输血医学的核心课题。在A型血的亚型谱系中,A3亚型属于罕见的表型变异,其红细胞表面A抗原的密度与常规A型存在显著差异。2017年我国科研团队在国际上首次报道了由新等位基因突变导致的A3亚型案例,这一发现不仅拓展了人类对血型遗传多样性的认知,更揭示了ABO基因座在进化过程中复杂的分子机制。
从抗原表达特征来看,A3亚型的红细胞与标准抗A试剂仅能形成微弱凝集,需通过增强试验(如酶处理或抗人球蛋白试验)才能确认。这类表型最早由Fisher于20世纪30年代提出,其形成机制与糖基转移酶活性降低直接相关。我国发现的特殊案例中,基因测序显示该个体携带的A等位基因在第六外显子区域存在移码突变,导致酶蛋白结构域功能异常,这为解释抗原弱表达提供了分子遗传学证据。
二、分子遗传学机制解析
ABO血型系统的抗原合成依赖于糖基转移酶的催化作用。正常A型个体通过α-1,3-N-乙酰半乳糖胺转移酶将N-乙酰半乳糖胺连接到H抗原的寡糖链末端。而A3亚型的形成,本质上源于该酶的结构或功能缺陷。日本学者山本昌弘团队的研究表明,这类突变多发生在基因编码区的关键位点,如第291位核苷酸的G→A替换会导致酶活性降低至正常水平的15%以下。
从群体遗传学角度,A3亚型的全球分布呈现显著地域差异。欧洲人群中的检出率约为0.02%,而亚洲地区由于基因多态性更丰富,个别族群可达0.1%。我国学者在云南少数民族中发现的特殊家系显示,该突变型遵循孟德尔显性遗传规律,但外显率受修饰基因影响呈现不完全显性特征。这类发现为研究早期人类迁徙过程中的适应性进化提供了新线索。
三、临床输血医学意义
在临床实践中,A3亚型的误判可能引发严重输血反应。由于红细胞抗原表达微弱,常规正向定型易被误判为O型,而反向定型时血清中仍存在抗A抗体。2016年某三甲医院报告的案例显示,一例A3型患者被错误输注O型红细胞后,引发迟发性溶血反应,血红蛋白水平在24小时内骤降至5g/dL。这提示输血前必须采用吸收放散试验等增强技术进行精准分型。

针对此类特殊血型,我国已建立区域性稀有血型库。第三军医大学开发的AI辅助血型鉴定系统,通过微流控芯片与机器学习算法结合,可在30秒内完成包括A3在内的23种亚型识别,检测灵敏度达到99.7%。该技术的推广应用显著降低了交叉配血错误率,特别是在急诊抢救中展现出独特优势。
四、研究进展与未来方向

近年来,单细胞测序技术的突破为解析A3亚型的分子机制提供了新工具。2023年《血液学》期刊发表的研究揭示,A3型红细胞前体细胞在分化过程中,高尔基体内糖基转移酶的定位存在异常,导致抗原表位组装不完全。这种亚细胞器水平的发现,为开发体外抗原增强试剂提供了理论依据。
未来研究需重点关注三个维度:一是建立全球协作的稀有血型数据库,利用群体基因组学解析A3亚型的进化轨迹;二是开发基于CRISPR的基因编辑技术,探索体外修复突变基因的可能性;三是研究A3亚型与疾病易感性的关联,现有证据显示该类个体对诺如病毒GII.4株系的感染率较普通A型低40%,这可能与细胞表面糖链结构的差异相关。
A3亚型血型的发现与研究,不仅完善了ABO血型系统的理论框架,更推动了精准输血医学的革新。随着分子诊断技术的进步,对这类稀有血型的认知已从表型描述深入到基因调控网络解析层面。建议医疗机构强化血型亚型的常规筛查能力,科研机构应加强跨学科合作,特别是在糖生物学与免疫应答交叉领域开展攻关。未来的研究需着重揭示这类血型变异在人类适应性进化中的生物学意义,以及其在个体化医疗中的潜在应用价值。