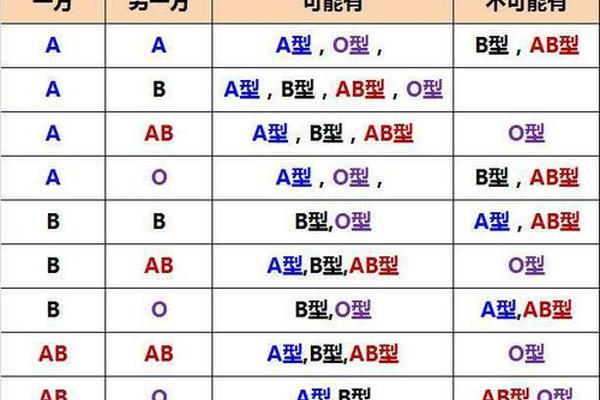
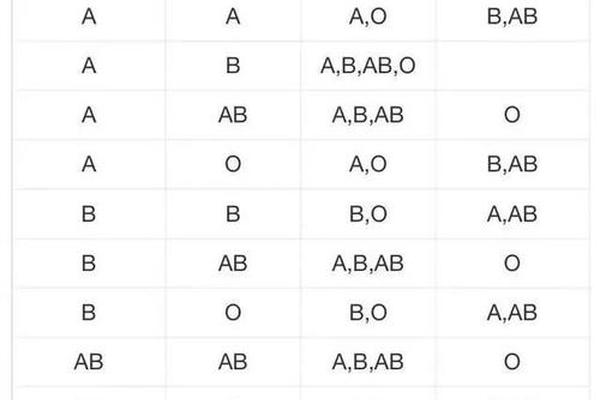
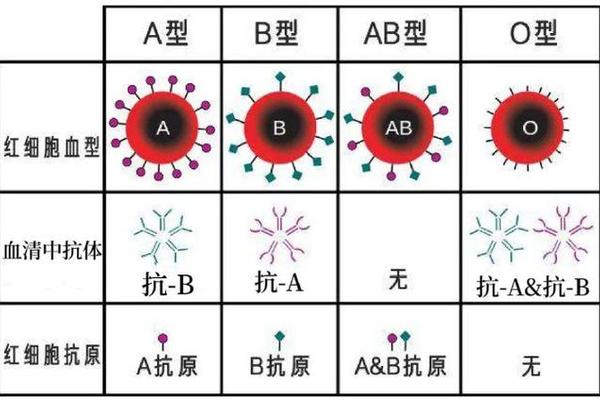
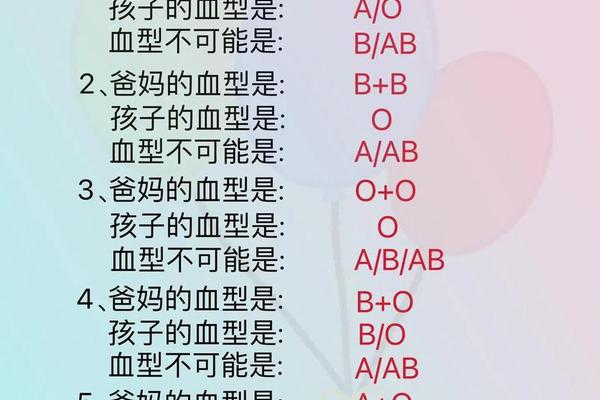
人类ABO血型系统由红细胞表面的抗原类型决定,其中A型血指红细胞表面携带A抗原的血液类型。根据抗原分子结构差异,A型血可进一步分为A1和A2亚型:A1型红细胞表面A抗原密度更高,而A2型抗原数量较少且存在分子结构变异。这种抗原差异导致输血时需特别注意亚型匹配,例如A2型患者接受A1型血液可能引发轻微溶血反应。值得注意的是,"A型血"与"a型血"在中文语境中常被混用,但严格来说,"a型血"可能指向隐性遗传的亚型或特定基因突变类型,目前学界尚未对此术语形成统一规范。
抗原差异不仅影响输血安全,还与免疫功能密切相关。研究发现,A抗原结构与某些病原体表面分子相似,例如幽门螺杆菌更易附着在A型血个体的胃黏膜上,导致其感染风险增加。这种分子模拟现象解释了为何A型血人群在特定疾病中呈现易感性。
二、遗传机制与亚型关联
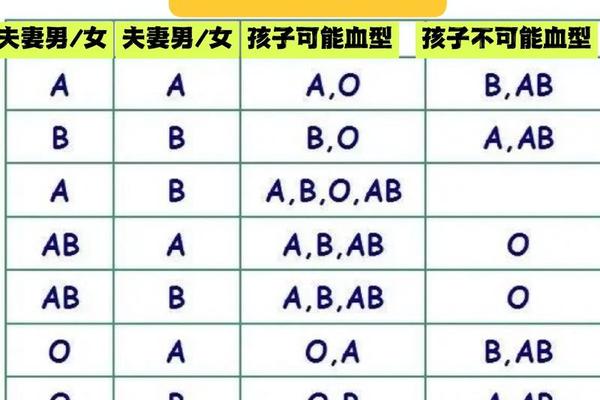
A型血的遗传由位于9号染色体的ABO基因决定。显性等位基因IA编码α-1,3-N-乙酰半乳糖胺转移酶,催化H抗原转化为A抗原。近年基因测序发现,IA基因存在超过300种变异体,其中IA1和IA2等亚型与疾病风险差异相关。例如携带IA2等位基因的个体,其胃癌发病率较IA1携带者降低19%。
在族群分布层面,A型血呈现显著地域特征。中国南方A型血占比达35%,而北方仅占22%,这可能与古代农耕文明扩张过程中A型血人群的适应性优势有关。值得注意的是,这种分布差异也影响了疾病流行病学特征,例如南方A型血人群的鼻咽癌发病率显著高于其他地区。
三、癌症风险的分子关联
大规模流行病学研究显示,A型血人群整体患癌风险较非A型血增加12%,其中胃癌风险提升18%,癌风险更高达23%。这种关联源于A抗原与肿瘤微环境的相互作用:A型个体血清中特定凝集素可促进肿瘤细胞间黏附,加速转移灶形成。日本学者发现,A抗原能够抑制自然杀伤细胞活性,使机体免疫监视功能下降。
特定癌症类型中,A型血的危险度更为显著。解放军总医院针对10万例消化道肿瘤的研究表明,A型血患者结直肠癌发生率是非A型血的1.3倍,且肿瘤侵袭深度与A抗原表达强度呈正相关。在乳腺癌领域,A型血女性的雌激素受体阳性率较O型血高14%,这可能与A抗原影响激素代谢通路有关。
四、心脑血管疾病机制
A型血与血栓形成存在显著关联。其血浆中von Willebrand因子浓度较O型血高25%,导致血小板聚集活性增强。美国国立卫生研究院对60万人的队列研究发现,A型血人群60岁前中风风险增加16%,深静脉血栓发生率是其他血型的1.92倍。这种促凝特性与A抗原介导的凝血因子Ⅷ稳定性增强有关。
在动脉粥样硬化领域,A型血个体的低密度脂蛋白氧化速率更快。芬兰赫尔辛基大学通过载脂蛋白B修饰实验发现,A抗原能促进氧化应激反应,使血管内皮损伤风险提升37%。这种分子机制解释了为何A型血人群冠心病患病率持续高于其他血型。

五、消化系统健康特征
A型血的消化系统脆弱性具有双重生物学基础。胃酸分泌量较O型血低30%,导致蛋白质消化效率下降。肠道菌群构成差异使A型血个体拟杆菌门丰度降低,而这类细菌对致癌物质亚硝胺的分解至关重要。临床数据显示,A型血人群功能性消化不良发生率是B型血的2.1倍,且胃食管反流病治疗周期延长20%。
幽门螺杆菌感染的分子机制进一步加剧风险。A抗原与细菌表面Lewis Y抗原的相似性,使感染率较O型血提升40%。这种持续性感染导致胃黏膜萎缩和肠化生,最终发展为胃癌的累积风险增加2.3倍。
总结与健康管理建议
A型血的生物学特性使其在癌症、血栓性疾病和消化系统疾病中呈现显著易感性。这种风险源于抗原-病原体相互作用、凝血机制异常及免疫调节失衡等多重因素。值得强调的是,血型仅是风险因素而非决定因素,后天干预可有效降低发病风险:定期进行胃镜和肠镜筛查(40岁起每3年1次)、维持膳食纤维摄入量(每日≥25g)、控制饱和脂肪酸比例(<总能量10%)等。未来研究需深入探索ABO抗原糖基化修饰的分子机制,开发针对A型血人群的精准预防策略。对于个体而言,建立基于血型的健康管理方案,远比纠结先天遗传更有现实意义。