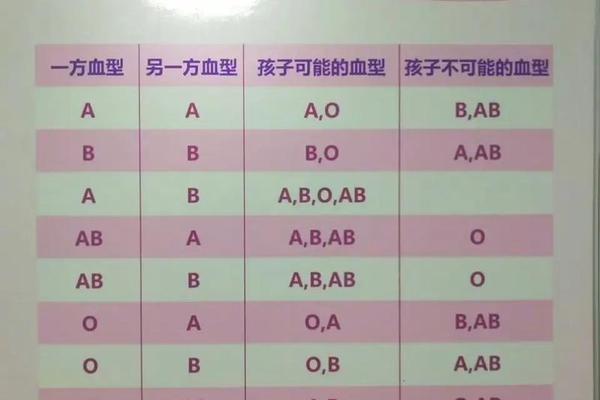
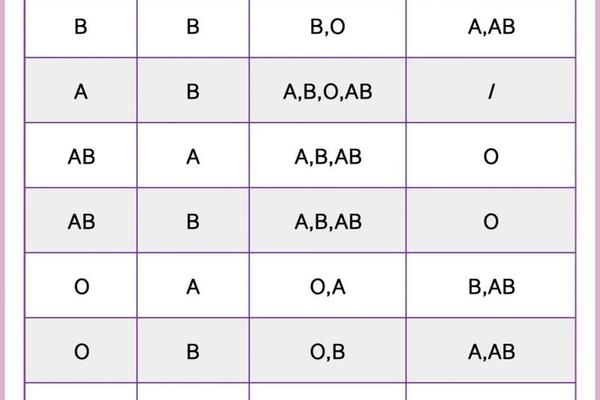
人类ABO血型系统由遗传基因决定,一般情况下具有终身稳定性。A型血的基因型为AA或AO,O型血则表现为隐性纯合子(OO)。根据孟德尔遗传定律,若父母中一方为A型(AO基因型),另一方为O型(OO),其子女可能表现为A型或O型,但这一过程属于遗传组合而非个体血型的主动变化。
从分子生物学角度看,血型抗原的形成依赖于特定糖基转移酶的活性。A型抗原的关键结构是N-乙酰半乳糖胺,而O型血则缺少这一末端糖基。研究表明,ABO基因位于第9号染色体长臂,其突变概率极低,因此自然状态下血型突变极为罕见。例如,2022年西安某医院报告的“A型患儿术后变O型”案例,最终证实为造血干细胞移植导致供者血型替代,并非基因层面的自然改变。
二、疾病与医疗干预引发的血型异常

某些病理状态可能造成血型检测的临时性改变。急性白血病患者因造血功能异常,可能出现红细胞表面抗原表达减弱。例如2024年某79岁骨科患者的A型血被误判为O型,经实验室分析发现其A抗原强度仅为正常值的58%,这与白血病细胞干扰糖基转移酶活性有关。这类“假性血型改变”会随原发病治疗而恢复,并非真实的血型转换。
造血干细胞移植是当前唯一可导致永久性血型改变的情况。当接受异基因移植后,患者血型将完全转变为供者类型。例如2023年深圳某MDS患者接受A型供者移植后,血型从O型转为A型,其红细胞抗原与性染色体均与供者一致。此类案例中,血型转变是移植成功的标志,但可能伴随长达数月的贫血期。
三、酶技术驱动的血型转换突破
2019年《自然·微生物学》的研究开辟了人工转换血型的新路径。科学家从人体肠道菌群中分离出Flavonifractor plautii菌株,其产生的两种酶能在30分钟内清除A型红细胞表面97%的抗原,转化效率较传统咖啡豆提取酶提升40倍。这种酶技术的关键突破在于:1)工作浓度仅需0.1μg/mL;2)适应生理温度与pH环境;3)不损伤红细胞膜完整性。
该技术已进入临床前试验阶段。2025年加拿大团队利用酶处理后的A型血进行动物输血实验,结果显示处理组溶血率低于1%,而未处理组在输注后1小时内即出现严重凝集。美国FDA指出,酶处理后残留的0.3%-2%抗原仍可能引发免疫反应,需建立更灵敏的质控标准。

四、血型认知误区与科学验证
公众对血型变化的误解常源于检测误差。2024年某女性婚检报告显示为O型,4年后人工授精前复检为B型。深入分析发现,其体内存在获得性类B抗原,这种由肠道菌群异常产生的半乳糖基团会干扰血型鉴定,但抗原强度随菌群调节可自行消失。此类情况需通过吸收放散试验、唾液血型物质检测等专业手段鉴别。
对于自测血型工具的可靠性也需审慎对待。市售试剂盒可能因操作不当(如稀释液比例错误)导致误判,某消费者自测显示B型,而医院检测确认为O型,差异源于未观察到微弱的A抗原凝集。世界卫生组织建议,关键医疗决策必须依赖经ISO15189认证的实验室检测结果。
血型系统的稳定性根植于遗传密码,但在疾病、移植及前沿技术干预下可能发生改变。当前酶转化技术虽取得突破,但距离临床普及仍需解决抗原清除彻底性、红细胞功能保全等难题。建议医疗机构加强血型检测的质控体系,同时推进多中心临床试验验证酶处理血液的安全性。未来研究方向可聚焦于:1)开发广谱酶制剂实现AB型血转换;2)建立动态监测移植后血型转变的生物标志物体系;3)探索血型转换技术在器官移植领域的延伸应用。正确认识血型变化的科学边界,既有助于消除公众误解,也将为血液医疗创新提供理论支撑。