人类血型系统的复杂性源于多个独立抗原系统的叠加,其中ABO血型系统和Rh血型系统是临床应用最广泛的两大分类标准。ABO血型系统基于红细胞表面A、B抗原的有无,将血液分为A型、B型、AB型和O型四大类。A型血特指红细胞携带A抗原,血清中含有抗B抗体的个体。而“A+”型血则是ABO与Rh双系统的复合描述,既表明该个体红细胞携带A抗原(A型血),又属于Rh血型系统中的阳性类别(Rh+),即红细胞表面存在D抗原。
ABO系统的抗原由基因编码的糖基转移酶决定,A型血的抗原合成需要N-乙酰半乳糖胺转移酶的催化作用。Rh系统的D抗原则由RHD基因控制,其存在与否直接决定Rh阳性或阴性。值得注意的是,Rh阴性人群在全球分布不均,中国汉族中Rh阴性比例不足1%,而欧美国家可达15%。这种生物学差异使得A+型血(A型Rh阳性)成为主流人群的血型之一,而A-型血(A型Rh阴性)则被归类为稀有血型。
二、亚型差异与抗原强度分层
A型血并非单一均质的群体,其内部存在抗原强度的分层现象。根据抗原表达强度的不同,A型血可细分为A1和A2两种亚型。A1亚型的红细胞表面同时携带A抗原和A1抗原,抗原性强且占A型人群的80%以上;A2亚型仅表达A抗原,抗原性较弱,易在常规血型检测中被误判为O型或B型。临床研究表明,A2亚型血清中可能含有抗A1抗体,若输血时未准确识别,可能引发溶血反应。
A+型血作为A型血在Rh系统中的阳性分支,通常与A1亚型相关联。实验数据显示,约99%的A+型血属于A1亚型,其抗原强度足以触发标准抗A试剂的凝集反应。极少数情况下,A+型血也可能表现为A2亚型,此时需通过更精细的分子检测技术(如DNA测序)确认血型。这种亚型分层的复杂性揭示了血型系统的微观多样性,也为精准医疗提出了更高要求。
三、临床输血与免疫反应风险
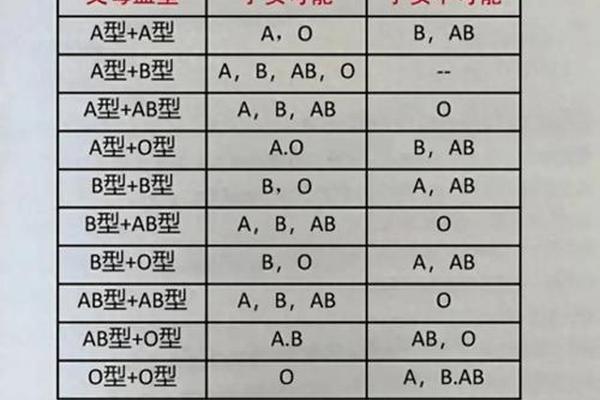
在输血医学中,A型与A+型血的区分具有关键意义。根据ABO系统规则,A型血患者可接受A型或O型供血;而Rh系统要求Rh阴性患者只能接受Rh阴性血液,但Rh阳性患者可接受Rh阳性或阴性血液。A+型血作为双重阳性血型,其输血兼容性优于A-型血。但需注意,若供血者血浆中含有高效价抗A抗体,即使ABO系统匹配,仍可能引发受血者红细胞溶解。
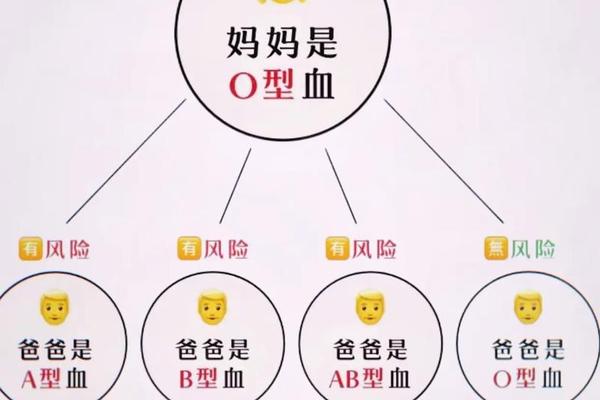
Rh系统的D抗原免疫原性极强,一次Rh阳性血液输注即可使Rh阴性个体产生抗D抗体。对于A+型血女性而言,若与Rh阴性配偶生育,胎儿可能继承Rh阳性基因,导致母体产生抗D抗体,进而引发新生儿溶血病。此类案例在跨种族婚姻中尤为突出,需通过产前抗体筛查和产后免疫球蛋白注射进行预防。
四、遗传机制与种群分布特征
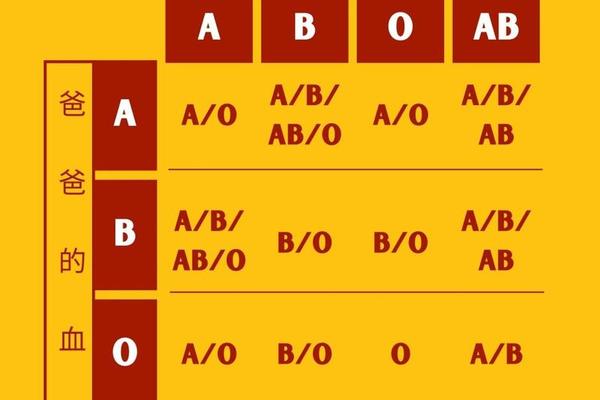
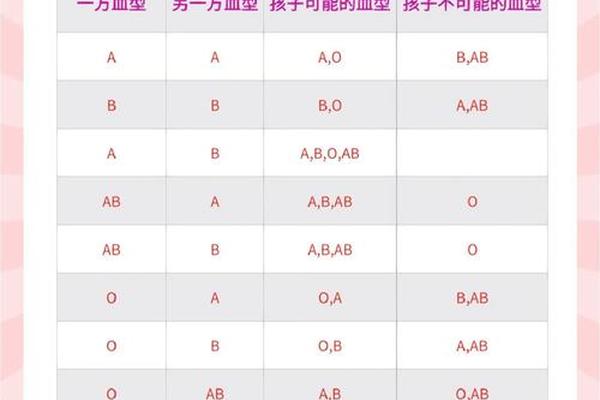
血型的遗传遵循孟德尔定律,A型血的产生需要至少一个显性IA基因。若父母基因型为IAIA或IAi,子女必为A型;若父母一方为IAIB(AB型),另一方为ii(O型),则子女有50%概率为A型。Rh阳性由显性RHD基因决定,因此A+型血的遗传需同时满足ABO系统IA基因传递和RHD基因的存在。统计显示,全球约32%的人口为A+型血,其在东亚地区的分布频率高达27%-35%,显著高于欧洲的22%-30%。
分子人类学研究揭示,A型血基因(IA)可能起源于旧石器时代采集者群体,而Rh阳性基因在非洲早期智人中已广泛存在。这种进化选择可能与传染病抵抗能力相关——A抗原可作为某些病原体(如疟原虫)的受体结合位点,而Rh阳性个体对特定细菌感染的易感性较低。
五、未来研究与技术突破方向
随着基因编辑技术的进步,血型系统的研究正从表型描述转向分子机制探索。近期CRISPR技术已成功用于体外红细胞的血型抗原修饰,这为通用型血液制品的开发提供了可能。针对A2亚型的快速检测试剂盒研发,可有效降低输血误判风险。在群体遗传学层面,建立区域性稀有血型数据库(如A-型血登记系统)将成为应急医疗体系的重要支撑。
对血型与疾病关联性的研究也呈现新趋势。全基因组关联分析(GWAS)发现,A型血人群胃癌发病率较其他血型高20%,而COVID-19重症风险与A型血的相关性仍有争议。这些发现提示,未来需建立多中心、大样本的血型-疾病关联图谱,为个性化预防医学提供依据。

A型血与A+型血的本质区别在于血型系统的层级划分:前者属于ABO系统的初级分类,后者则是ABO与Rh双系统的复合标识。这种区别在临床输血、器官移植和妊娠管理中具有决定性意义。随着精准医学的发展,血型检测已从简单的抗原抗体反应发展为涵盖基因测序、蛋白质组学的多维分析体系。建议医疗机构强化亚型检测能力,同时推进公众血型科普教育,特别是在稀有血型人群中建立互助网络。未来的研究应聚焦于血型抗原的免疫调控机制,以及血型转换技术的临床转化,最终实现血液资源的优化配置与零风险输注。