血型作为人类血液的遗传标记,其复杂性远超公众的普遍认知。当我们谈论"HB血型"时,实际上涉及两个需要澄清的概念:其一是可能被误写的"B(A)血型",这是一种罕见的ABO亚型;其二则是血红蛋白(Hemoglobin,简称Hb)相关的研究领域。这种专业术语的混淆恰恰反映出公众对血型系统深层机制的认知空白。本文将从血清学特征、遗传学机制、临床意义和研究前沿四个维度,系统解析这一特殊的血液遗传现象。

血清学特征解析
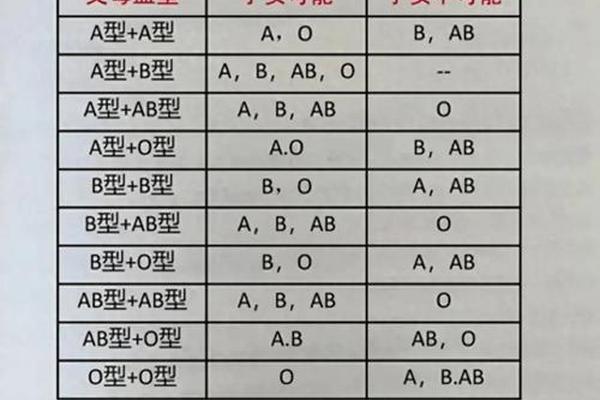
B(A)血型在常规血型检测中呈现出特殊的反应模式。在正定型试验中,红细胞与抗A试剂呈现弱阳性(++),与抗B试剂则显示强阳性(++++),这种反应格局初看类似AB型。但在反定型环节,血清与A1型红细胞仅发生弱凝集,与B型和O型红细胞无反应,这种正反定型不符的现象提示存在ABO亚型的可能。
这种特殊表型的本质在于红细胞表面抗原的异常表达。正常B型血的红细胞仅表达B抗原,而B(A)血型红细胞通过基因突变产生的酶具有双重催化功能,既能合成B抗原,又具备微弱的A抗原合成能力。研究显示,B(A)型红细胞的A抗原密度仅为正常A型的1/1000-1/2000,这解释了其弱反应性的特征。这种微量的A抗原需要采用高灵敏度的吸收放散试验或分子检测才能准确识别。
遗传突变机制
B(A)血型的形成源于ABO基因的特定位点突变。全基因测序发现,该亚型的核心突变发生在第7外显子的640A>G位点,这种错义突变导致编码的糖基转移酶获得双重催化活性。正常B型基因编码的α-1,3-半乳糖胺基转移酶只能将半乳糖连接到H抗原,而突变后的酶还能微弱催化N-乙酰半乳糖胺的连接,从而产生少量A抗原。
这种突变遵循显性遗传规律,但表现存在剂量效应。当携带BA/O基因型时,红细胞仅显示弱A抗原;若为BA/BA纯合子,A抗原表达可能增强至可检测水平。中国人群中的BA.02等位基因频率约为0.0003%,对应表型发生率约百万分之一,目前国内仅记录9例。这种极低的发生率使得常规血型检测极易漏诊。
临床输血安全
在输血医学实践中,B(A)血型面临双重挑战。作为供体时,其红细胞携带的微量A抗原可能引发O型或A型受血者的免疫反应。研究显示,当输注量超过200ml时,抗A抗体的累积可能诱发迟发性溶血反应。因此建议首选同型血液,在紧急情况下可使用O型洗涤红细胞,但需保证交叉配血完全相合。
作为受血者时,其血清中含有正常水平的抗A抗体。若误输注A型血液,即使微量也可能导致急性溶血反应。某临床案例显示,B(A)型患者输注2单位A型红细胞后,血红蛋白尿在6小时内出现,血红蛋白下降速度达1.5g/L/h。这要求血库必须建立ABO亚型的快速鉴别流程,特别是在正反定型不符时启动分子检测程序。
研究前沿进展
近年来,血型基因分型技术为稀有血型研究开辟新路径。与血清学方法相比,PCR-SSP、Sanger测序等分子检测手段能准确识别单核苷酸多态性,避免抗原表达异常的干扰。我国学者已建立包含45个ABO等位基因的数据库,其中B(A)04等位基因的特异性探针可将检测灵敏度提升至0.1%。
群体遗传学研究揭示了该血型的地域分布特征。在云贵高原少数民族中,B(A)基因频率达到0.002%,显著高于汉族人群,提示可能存在遗传隔离现象。这种分布差异为人类迁徙研究提供了新线索。与此科学家正在探索基因编辑技术在稀有血型转换中的应用,通过CRISPR-Cas9修正BA基因的突变位点,已在小鼠模型中实现B(A)向标准B型的转化。
从B(A)血型的特殊现象我们可以看到,血型系统的复杂性远超传统认知。这个案例不仅揭示了基因突变如何创造新的生物表型,更凸显了精准医学在输血安全中的核心价值。未来研究应着重于建立全国性的稀有血型库,开发快速床旁检测设备,并深入探索血型抗原的免疫调节机制。随着单细胞测序技术的进步,我们有望绘制出更完整的血型抗原表达图谱,为个体化输血治疗奠定基础。