在医学领域,ABO血型系统的复杂性不仅体现在其抗原与抗体的特异性反应上,更在于某些特殊情境下可能出现的检测异常。当提及"A型血存在A抗体并与抗A抗体发生凝集"这一现象时,看似矛盾的表象背后往往隐藏着血型亚型、检测干扰或特殊免疫反应等深层机制。这类问题的解析不仅关系到临床输血的精准性,更是理解人类血液免疫学多样性的重要窗口。
ABO血型系统的抗原抗体特性
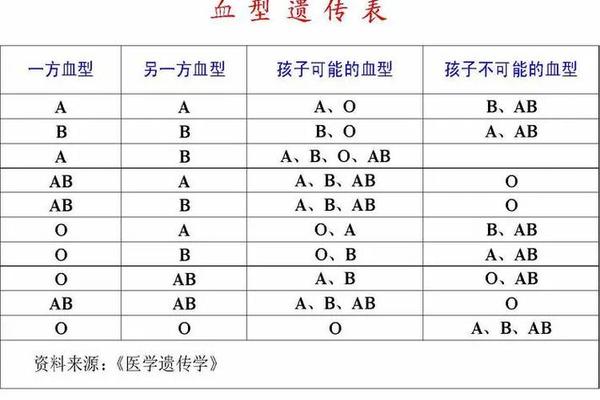
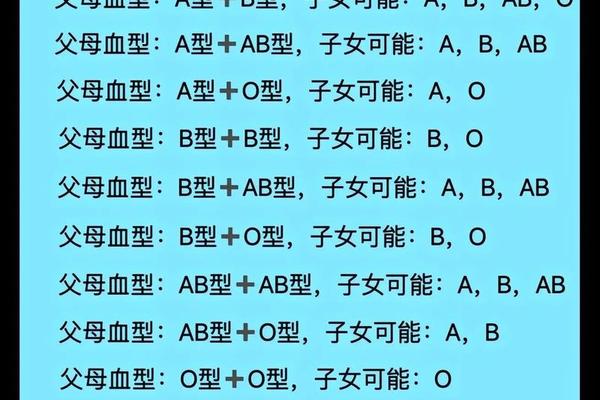
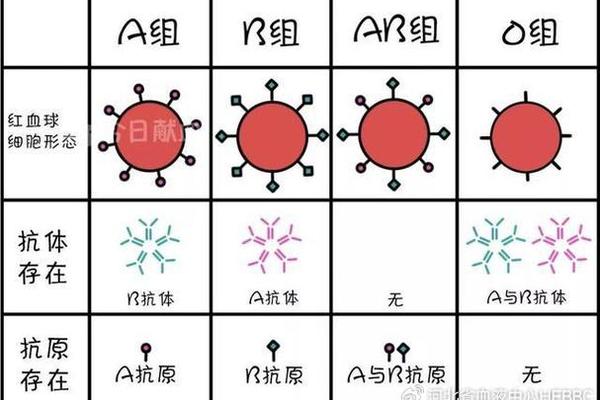
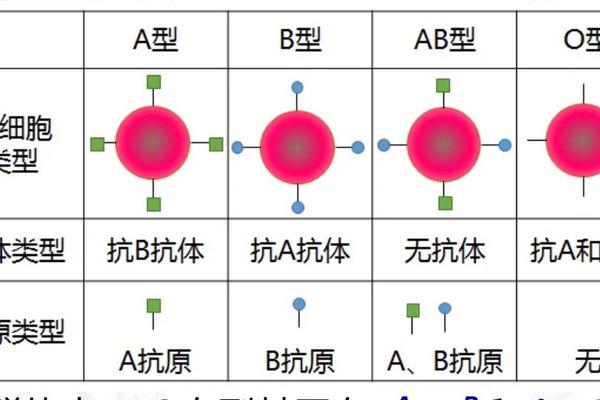
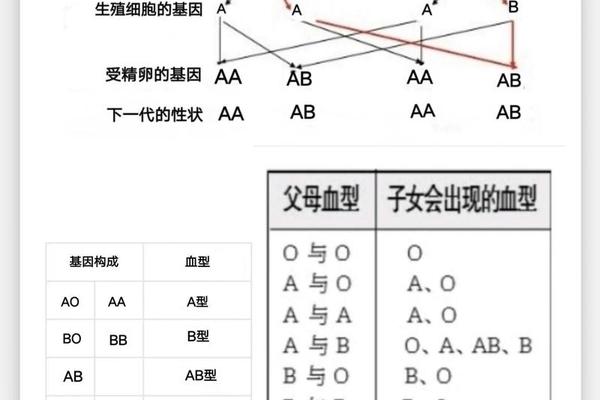
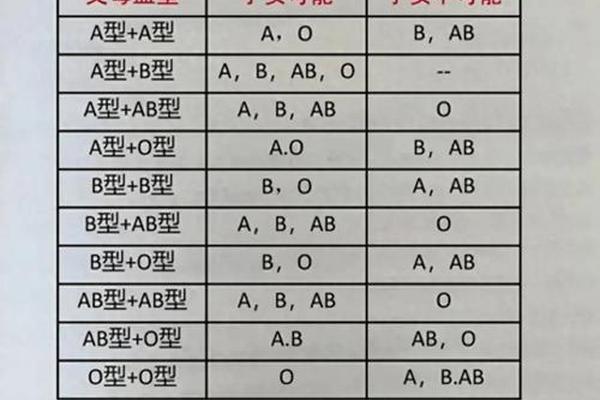
ABO血型系统的核心特征在于红细胞表面抗原与血清中抗体的对应关系。根据经典理论,A型血个体的红细胞表面表达A抗原,血清中天然存在抗B抗体;B型血则相反,红细胞携带B抗原,血清中含抗A抗体;AB型同时具有A、B抗原而无相应抗体;O型则缺乏A、B抗原,但血清中同时存在抗A和抗B抗体。这种抗原-抗体的互补性构成了输血安全的基础框架。
当出现"A型血含有A抗体"的异常报告时,首先需要排除实验误差。例如在反向定型中,若患者血清与标准A型红细胞发生凝集,提示血清中存在抗A抗体,这与A型血的血清学特征直接矛盾。此时需考虑样本混淆、试剂失效或操作失误等技术因素。新生儿或免疫缺陷患者可能因抗体生成不足导致反向定型错误,需结合临床背景综合判断。
血型亚型与抗原变异的可能
在排除技术因素后,血型亚型的可能性成为首要研究方向。A型血存在A1、A2等亚型分化,其中A2亚型红细胞表面的A抗原表达较弱,可能导致某些检测试剂无法有效识别。更为特殊的是Ax亚型,其抗原结构异常可能引发自身抗A抗体的产生。例如在A2亚型个体中,约有1%-8%的人血清中可检测到抗A1抗体,这种不规则抗体会与标准A1型红细胞发生凝集。
抗原变异还可见于某些病理状态。白血病、实体肿瘤等疾病可能通过影响糖基转移酶活性导致A抗原表达减弱或结构改变,形成获得性类B抗原或H抗原暴露现象。此类情况下,原本应为A型的红细胞可能因抗原缺失而被误判为O型,同时血清中残留的抗A抗体会与标准A型红细胞发生反应,形成"假矛盾"现象。此时需通过吸收放散试验、分子生物学检测等手段确认抗原本质。
检测干扰因素的多维度分析
实验过程中的物理化学因素可能显著影响检测结果。高球蛋白血症患者(如多发性瘤)血清中过量的免疫球蛋白可引起缗钱状假凝集,这种非特异性聚集可能被误判为抗原-抗体反应。类似现象也见于使用右旋糖酐等血浆扩容剂后,其高分子量物质会改变红细胞表面电荷分布,导致假阳性结果。此时通过盐水置换或酶处理可消除干扰。

特殊抗体类型的存在可能突破常规检测方法的局限。虽然ABO系统抗体以IgM为主,但在反复输血或妊娠刺激下可能产生IgG型抗A抗体。这类抗体在盐水介质中无法引起直接凝集,但通过抗人球蛋白试验可检测到致敏红细胞的潜在风险。类抗A抗体可能由环境微生物刺激产生,如某些肠道细菌表面的多糖结构与A抗原相似,可能诱导交叉反应性抗体的生成。
临床输血安全的应对策略
面对异常血型报告,输血科需建立系统化的处置流程。首先应重复检测并采用不同方法学验证,如将盐水介质法与凝胶微柱法结合使用。对于疑似亚型病例,需补充吸收放散试验、唾液血型物质测定等特殊检测,必要时进行基因分型以确认ABO基因型。在2015年我国首例Ael亚型鉴定案例中,正是通过基因测序发现了罕见的ABOAW.10等位基因突变。
在紧急输血场景下,当发现患者血清与所有同型供血者红细胞均出现主侧凝集时,应启动稀有血型应急预案。此时选择O型洗涤红细胞虽可避免ABO系统不相容,但仍需警惕其他血型系统(如Rh、Kidd系统)抗体的存在。某医院曾报告一例O型RhCCDee患者,其血清中抗C抗体导致多袋O型血交叉配血不合,最终通过表型匹配输血解决临床危机。

未来研究方向与挑战
随着分子诊断技术的发展,血型鉴定正从血清学表型向基因型分析深化。二代测序技术可精准识别ABO基因的单核苷酸多态性,为解释亚型形成机制提供分子基础。基因型与表型的不完全对应仍是难题,例如某些沉默等位基因可能干扰检测结果的解读。建立中国人群特异性血型抗原数据库,对提高罕见血型识别效率具有重要意义。
在临床转化层面,开发快速检测试剂盒成为迫切需求。新型纳米材料标记技术可将检测灵敏度提升10倍,有助于发现弱表达抗原。人工智能辅助判读系统的应用,则能有效降低主观误判率,某研究显示AI对复杂凝集模式的识别准确率达98.7%。这些技术创新将推动输血医学进入精准化时代。
总结而言,A型血与抗A抗体的异常反应揭示了血液免疫学的复杂本质。从亚型变异到检测干扰,从抗体特性到临床对策,这一现象串联起基础研究与临床实践的多个维度。未来的研究需在分子机制解析、检测技术创新、临床决策优化三个方向持续突破,为输血安全构筑更坚实的科学防线。