在人类复杂的血液系统中,ABO血型与Rh血型共同构成了输血医学的基石。当我们在体检报告上看到"A型血"的标识时,这个简单的字母背后其实隐藏着精密的生物学编码系统。若进一步细分为A+(A Rh阳性)和A-(A Rh阴性),二者的差异不仅体现在红细胞表面的抗原结构,更关系到临床输血安全、疾病易感性乃至人类遗传学研究。这种差异性的本质源于9号染色体上的ABO基因与1号染色体上的RhD基因的协同表达,形成了每个人独特的血型密码。
抗原与抗体的分子差异
A型血的核心特征在于红细胞表面携带的A抗原,这种糖蛋白结构由9号染色体上的A等位基因编码的α-1,3-N-乙酰半乳糖胺转移酶催化形成。无论是A+还是A-,其ABO系统的抗原基础完全一致,都包含A抗原及血浆中的抗B抗体。差异的关键在于Rh血型系统,RhD抗原的存在与否构成了"+"与"-"的区分标准。RhD抗原是位于红细胞膜上的跨膜蛋白,其编码基因位于1号染色体短臂,阳性个体至少携带一个RhD基因拷贝。
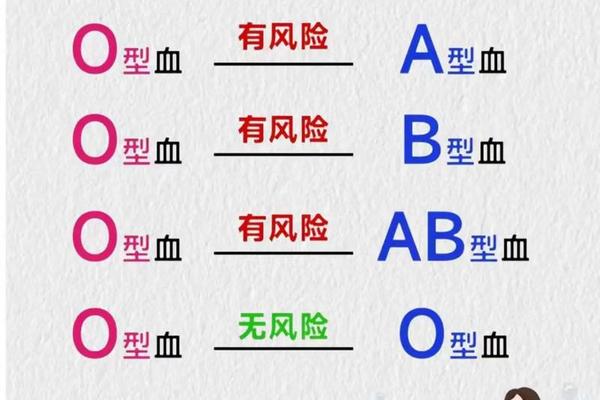
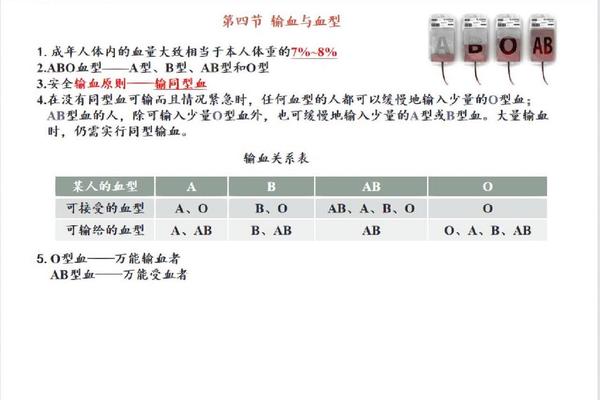
这种分子差异带来了显著的免疫学后果。Rh阴性个体的血浆中原本不含抗RhD抗体,但在接受Rh阳性血液后,免疫系统会产生IgG型抗体。这种致敏过程具有终身记忆性,二次接触Rh阳性红细胞时可能引发严重的溶血反应。因此A-型血作为稀有血型(仅占中国人口的0.3%),其输血策略需要严格遵循同型输注原则。
临床输血的特殊限制
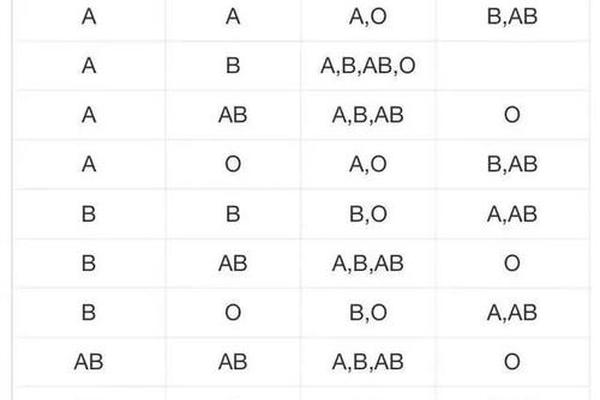
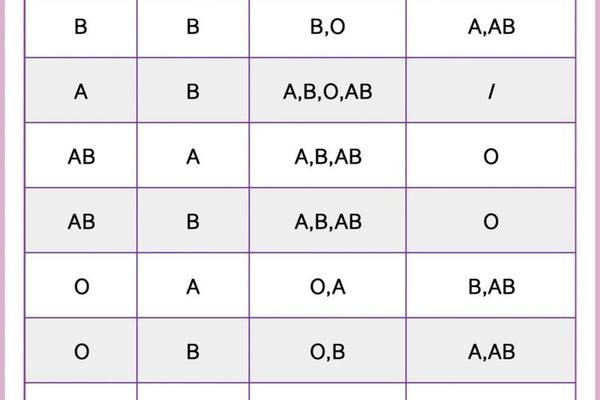
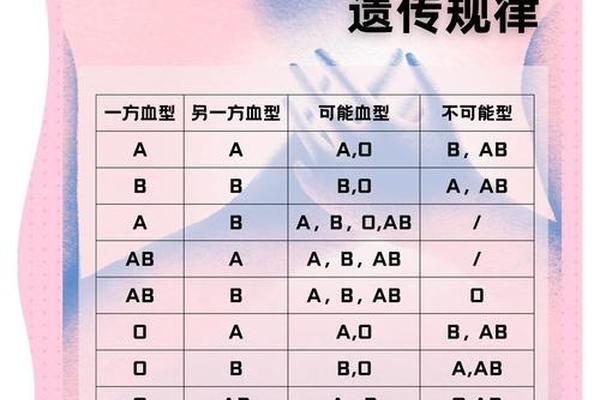
在常规输血实践中,A+型可以接受A+或O+型血液,而A-型理论上可接受A-或O-型血液。但近年研究发现,ABO亚型的存在可能改变这种规则。例如A2亚型(占A型人群的20%)的红细胞A抗原密度较低,其血浆中可能含有抗A1抗体,若误输给A1型患者可能引发迟发性溶血反应。这要求现代输血医学必须通过抗球蛋白试验、吸收放散试验等精细检测手段来确保安全。
对Rh阴性孕妇的临床管理尤其需要谨慎。当A-型母亲孕育Rh阳性胎儿时,胎儿的红细胞可能通过胎盘屏障进入母体循环,刺激产生抗RhD抗体。这种IgG抗体可穿透胎盘引发新生儿溶血病,因此需要通过产前抗体筛查和产后72小时内注射Rh免疫球蛋白进行预防。数据显示,未接受预防措施的Rh阴性母亲,第二胎发生新生儿溶血的概率高达16%。
遗传学与进化的双重编码
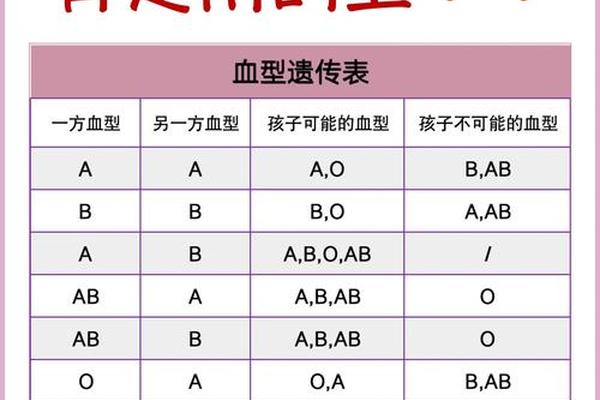
从遗传学角度观察,A型血的传递遵循显性遗传规律。父母若分别为AO和BO基因型,其子女可能出现AB型(概率25%),这种显性表达特征在法医学亲子鉴定中具有重要价值。Rh系统的遗传则更为复杂,涉及RHD和RHCE两个紧密连锁的基因座,其基因缺失或重组可能产生D变异型等特殊表型。
进化生物学研究揭示了血型分布的深层逻辑。A型血在东亚人群中的高频率(约28%)可能与古代瘟疫的选择压力相关,某些研究表明A抗原结构与霍乱弧菌的粘附位点存在分子模拟现象,可能提供部分保护作用。而Rh阴性血型在欧洲的高发生率(15%)则暗示其可能与古代人群迁徙、隔离繁殖等进化事件相关。
疾病易感性的差异图谱
近年大规模流行病学研究揭示了血型与疾病的相关性。A型人群(无论Rh状态)被证实具有较高的胃癌、癌风险,其机制可能与A抗原促进幽门螺杆菌定植有关。而Rh阴性个体在血栓性疾病中的保护作用引发关注,统计显示Rh-人群静脉血栓发生率较Rh+低30%。这种差异可能与RhD蛋白参与凝血因子调控的分子机制相关。
在传染病领域,新冠大流行期间的观察数据显示,A型血患者更易出现重症化倾向,而O型血表现出相对保护作用。虽然具体机制尚未完全阐明,但学者推测血型抗原可能通过影响病毒刺突蛋白与ACE2受体的结合效率来调节感染过程。这为个性化医疗提供了新的研究方向。
未来医学的发展方向
基因编辑技术的突破为血型转化带来曙光。2022年剑桥大学团队利用嗜黏蛋白阿克曼菌提取的酶制剂,成功将肾脏供体的血型转化为通用型O型,这项技术突破有望缓解器官移植中的血型限制。在血液制品领域,日本学者开发的磁珠法抗原清除技术,可将A型红细胞转化为O型,临床试验显示转化后的红细胞存活率与天然O型血无统计学差异。

对血型系统的深入研究仍在持续推进。单细胞测序技术揭示了同一个体内红细胞抗原表达的异质性,这解释了为何某些"弱A"表型会导致血型鉴定误差。合成生物学则致力于构建人工血型抗原,用于制备标准化血型试剂。这些创新不仅推动着输血医学的进步,更为人类理解免疫系统的进化提供了独特视角。
从红细胞表面的糖链结构到染色体上的基因密码,从临床输血的安全法则到疾病预防的精准策略,A+与A-型血的差异映射出生命科学的精妙复杂。这种差异既是进化留给人类的生物学印记,也是现代医学必须跨越的技术鸿沟。随着基因编辑、合成生物学等前沿技术的发展,人类终将突破血型限制的桎梏,但在当前医疗实践中,严格遵守血型配型规则,完善稀有血型库建设,仍是保障输血安全的核心要务。未来的研究需要更深入解析血型抗原的免疫原性机制,开发广谱相容的血液替代品,让每个生命都能平等享有血液救治的权利。