人类ABO血型系统的发现开启了血液免疫学的先河,其中A型血作为该系统的核心组成部分,其红细胞表面特有的A抗原不仅是遗传标记,更是免疫识别与临床医学的重要研究对象。这种由糖链结构组成的抗原分子通过复杂的生物合成途径形成,在输血安全、疾病易感性及病原体感染等生命过程中扮演着关键角色。深入理解A抗原的分子特性及其生物学意义,对于推进精准医疗和揭示生命本质具有深远影响。
抗原A的分子结构与生物合成
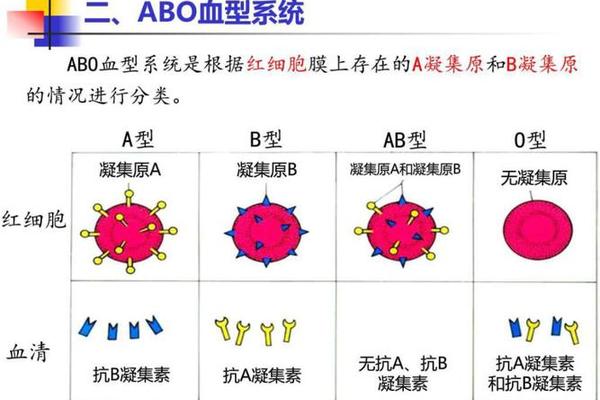
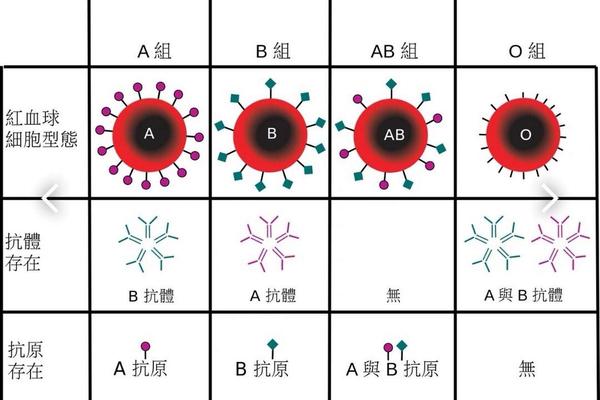
A型血个体的红细胞表面抗原由N-乙酰半乳糖胺(GalNAc)通过α-1,3糖苷键连接于H抗原的β-D-半乳糖末端形成。这一过程依赖于位于9号染色体的IA基因编码的α-1,3-N-乙酰半乳糖胺转移酶,该酶特异性催化H抗原向A抗原的转化。值得注意的是,H抗原本身是ABO抗原的基础前体物质,其合成由FUT1基因调控的岩藻糖转移酶完成,缺乏H抗原的个体将表现为罕见的孟买血型,无法正常形成A或B抗原。
从遗传学角度,IA基因存在20余种亚型变异,其中A1亚型占80%以上,而A2亚型因酶活性差异导致抗原表达较弱。这种分子层面的多态性解释了临床血型鉴定中出现的弱A现象,例如B(A)血型个体因基因嵌合导致红细胞同时携带B抗原和微量A抗原,易被误判为AB型。分子生物学检测技术通过分析基因外显子的核苷酸序列,可准确识别此类罕见血型,为安全输血提供保障。
抗原A的血清学特性与临床意义
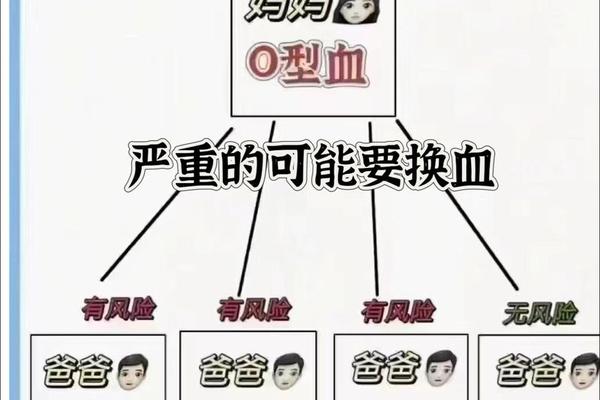
A型血个体的血清中天然存在抗B抗体(IgM型),这种抗体在出生后6-12个月内通过环境微生物的交叉反应诱导产生。在输血实践中,A型受血者仅能接受A型或O型血液,若输入B型血将引发抗B抗体与供体红细胞的剧烈溶血反应。研究显示,O型血浆中的抗A抗体在大量输血时仍可能引发迟发性溶血,因此现代输血医学已摒弃“万能供血者”概念,强调同型输注原则。

母婴血型不合是A抗原引发临床问题的另一重要场景。当A型胎儿红细胞通过胎盘进入O型或B型母体时,母体产生的IgG型抗A抗体可穿越胎盘屏障,导致新生儿溶血病。统计表明,第二胎患儿的溶血严重程度显著高于第一胎,这与母体记忆性B细胞二次免疫应答的强度相关。针对此类病例,产前抗体筛查与产后光疗干预已成为降低致残率的关键措施。
抗原A的遗传多态性与疾病关联
全基因组关联研究发现,A型血个体患胃癌的风险较O型血增加20%,其机制可能与幽门螺杆菌特异性结合A抗原有关。该病原体通过表面黏附素BabA识别胃上皮细胞的Leb抗原(A型衍生糖链),促进定植并诱发慢性炎症。A型血人群心血管疾病发病率较高,可能与血管内皮细胞A抗原介导的血小板活化增强有关。
在病毒感染领域,轮状病毒P型毒株被发现通过VP8蛋白特异性识别A抗原,这解释了A型血婴幼儿更易感染该病毒的现象。值得注意的是,A抗原的表达水平具有组织特异性,例如唾液腺和消化道上皮的A抗原丰度显著高于红细胞,这种差异分布为黏膜免疫研究提供了新视角。
研究进展与未来方向
近年来单细胞测序技术揭示了A抗原合成的表观遗传调控机制,发现DNA甲基化可影响IA基因启动子活性,这为解释环境因素对血型表达的影响提供了分子基础。在临床应用层面,基于A抗原糖链结构设计的纳米载体已在靶向药物递送系统中展现潜力,其特异性结合特性可提高肿瘤治疗的精准度。
未来研究需重点关注三个方向:其一,建立A抗原亚型的快速检测技术,解决罕见血型鉴定的临床难题;其二,探索血型抗原与肠道菌群的互作机制,阐明其在代谢性疾病中的作用;其三,开发人工合成A抗原类似物,用于中和病原体感染或调控免疫应答。跨学科技术的融合将推动血型研究从表型描述迈向功能解析的新阶段。
抗原A作为A型血的分子标志,其精细的糖链结构既是生命进化的产物,也是疾病发生的枢纽。从输血安全到疾病易感性,从病原体感染到精准医疗,对A抗原的深入研究不断拓展着人类对生命系统的认知边界。随着糖生物学与系统医学的深度交叉,解密血型抗原的“糖密码”将成为突破诊疗技术瓶颈的关键,为个体化医疗开辟新的可能性。这不仅需要基础研究的持续投入,更呼唤临床医学、生物信息学与材料科学的协同创新。