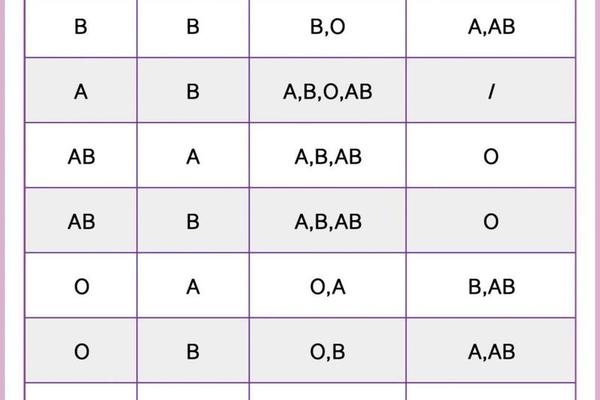
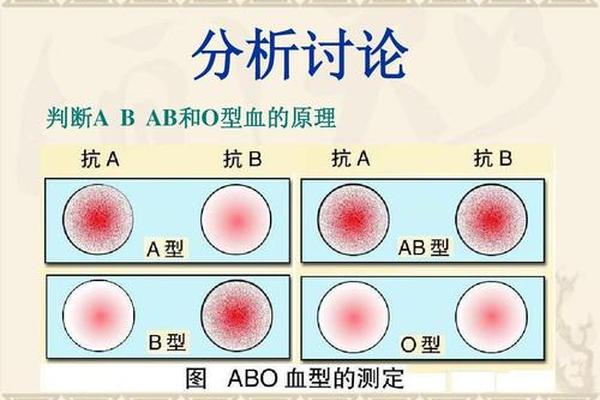
人类血型系统的复杂性不仅体现在临床输血的重要性上,更隐藏于其分子结构的精妙差异中。ABO血型作为首个被发现的血型系统,其抗原决定机制曾引发长期争论:究竟是糖脂还是糖蛋白承载着血型特异性?这一问题的答案,不仅关乎基础生物学认知,更对临床医学、法医学乃至人类学研究具有深远意义。血型糖蛋白A(Glycophorin A, GPA)的发现与研究,为揭示这一谜题提供了关键线索。
分子结构:糖链末端的决定性作用
血型抗原的本质差异源于红细胞膜表面糖分子结构的微小变化。研究表明,ABO抗原的核心是附着于糖脂或糖蛋白上的低聚糖链,其末端糖基的类型直接决定抗原特异性。例如,A型抗原末端为N-乙酰半乳糖胺,B型为半乳糖,而O型则缺失这两个关键糖基。这种差异仅涉及单个糖基的增减,却足以引发免疫系统的特异性识别。
血型糖蛋白A作为红细胞膜上的跨膜糖蛋白,其分子结构为这一机制提供了直接证据。GPA由131个氨基酸构成,携带16条寡糖链,其中N端结构域暴露于细胞膜外,包含多个O-糖基化位点。通过扫描隧道显微镜观察发现,GPA在水溶液中呈现纤维状结构,糖链呈树枝状向外延伸,这种空间构象为抗原表位的暴露提供了物理基础。值得注意的是,无论是糖脂还是糖蛋白,其抗原决定簇均位于糖链末端,表明糖链结构本身才是血型特异性的根本来源。
载体之争:糖蛋白与糖脂的功能分化
早期研究认为ABO抗原主要存在于糖脂分子中。1980年之前,学界普遍将鞘糖脂视为血型抗原的主要载体,因其化学性质稳定且易于分离。但随着技术进步,研究发现红细胞膜上约80%的ABH抗原实际上通过糖蛋白呈现,特别是带3蛋白(Band 3)和葡萄糖转运蛋白等跨膜糖蛋白。这些糖蛋白通过N-乙酰氨基乳糖多聚物形成高度分枝的糖链结构,显著增加了抗原表位的密度。
糖脂与糖蛋白在血型表达中的角色差异具有生物学意义。糖脂抗原多分布于细胞膜脂筏区域,参与细胞信号传导;而糖蛋白抗原因其跨膜特性,更易与外界环境相互作用。例如,GPA不仅是MN血型系统的抗原载体,还作为流感病毒受体参与病原体识别。这种功能分化提示,血型抗原可能通过不同分子载体实现生物学功能的多样性拓展。
遗传调控:基因编码的酶学机制
ABO血型的遗传本质由9号染色体上的ABO基因座控制。该基因编码的糖基转移酶直接决定抗原合成路径:A等位基因产生N-乙酰半乳糖胺转移酶,B等位基因编码半乳糖转移酶,而O等位基因因移码突变丧失酶活性。这种酶促反应的核心作用部位正是糖链末端,无论是糖脂还是糖蛋白的糖链修饰均遵循相同生化原理。

H抗原系统的发现进一步揭示了载体分子的从属性地位。FUT1基因编码的岩藻糖转移酶先将岩藻糖连接至前体物质形成H抗原,该过程发生在糖脂分子上。此后ABO基因产物才能对H抗原进行进一步修饰。这种级联反应表明,糖脂可能承担基础抗原框架的构建,而糖蛋白更多作为修饰后的终末载体。分子生物学实验证实,通过酶处理切除糖链末端特定糖基,可成功实现B型红细胞向O型的转化,这为人工调控血型提供了理论依据。
技术突破:研究手段的认知革新
研究方法的革新深刻改变了学界对血型载体的认知。早期采用氯仿-甲醇抽提法分离糖脂抗原时,常因去垢剂残留影响结果判断。20世纪80年代单克隆抗体技术的应用,首次揭示糖蛋白携带的抗原在免疫反应中占据主导地位。近年冷冻电镜与质谱联用技术更精确量化了不同载体的抗原分布:在单个红细胞表面,约5×10⁵个ABH抗原中,68%通过糖蛋白呈现,32%分布于糖脂。
血型糖蛋白A的提纯与表征成为关键突破点。通过选择性抽提法获得的高纯度GPA,其STM图像清晰显示出2nm宽度的纤维状结构,糖链呈周期性突起。这种直观观察证实了糖蛋白作为抗原载体的结构可行性。比较研究显示,糖蛋白抗原的免疫原性比糖脂强3-5倍,这可能与糖蛋白的刚性结构更易被抗体识别有关。
血型决定机制的本质在于糖链结构的特异性,而非单纯依赖糖脂或糖蛋白载体。糖脂构建基础抗原框架,糖蛋白则通过复杂糖基化实现抗原多样性表达,两者在空间分布和功能上形成互补。这种双重载体系统既保证了血型抗原的稳定性,又赋予其应对进化压力的可塑性。
未来研究应着重于:1)开发高分辨率成像技术,动态观察糖链修饰过程;2)探索糖脂-糖蛋白相互作用对血型表达的影响;3)利用基因编辑技术构建特定糖链结构的细胞模型。临床转化方面,人工酶修饰血型技术已展现潜力,但需解决修饰效率与安全性问题。理解血型载体的分子本质,将为精准医疗、器官移植和法医学鉴定开辟新的可能性。