人类对血型系统的认知始于1900年卡尔·兰德斯坦纳的划时代发现,他通过红细胞凝集实验首次揭示了ABO血型系统的基本框架。在这一系统中,A型血作为第二大群体,其复杂性远超表面认知——根据抗原表达的差异,A型血可细分为A1、A2、A3等20余种亚型。理解A型血及其亚型的生物学特性,不仅是输血医学安全性的基石,更是探索疾病易感性、遗传特征的重要窗口。
一、抗原结构与分型依据
A型血的本质特征在于红细胞膜表面存在A抗原,其分子基础是前体物质H抗原末端连接N-乙酰半乳糖胺的特定糖链结构。这种抗原的形成由9号染色体上的ABO基因调控,显性等位基因IA编码的α-1,3-N-乙酰半乳糖转移酶催化关键糖基转移反应。然而在临床实践中发现,不同个体的A抗原表达强度存在显著差异,这种差异直接催生了A型亚型的概念。
1930年科学家首次将A型分为A1和A2两种主要亚型,二者抗原结构的区别在于A1型红细胞表面同时存在A和A1抗原,而A2型仅保留基础A抗原。通过单克隆抗体检测发现,A1型每个红细胞携带约81-117万个A抗原位点,而A2型仅有24-29万个,这种数量级差异导致二者在血型鉴定时呈现不同凝集强度。A3、Ax等稀有亚型由于抗原表位结构异常或酶活性缺陷,抗原表达更为微弱,甚至需要吸收放散实验才能检出。

二、血清学检测与误判风险
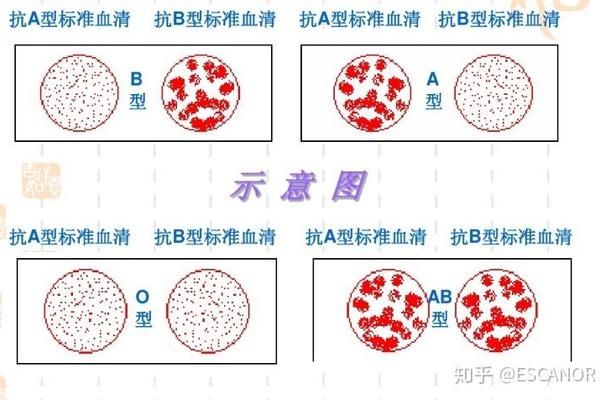
常规ABO血型鉴定依赖于红细胞与标准血清试剂的凝集反应。对于典型A1型,抗A试剂会产生强凝集,而A2型可能仅呈现弱阳性反应。更复杂的Ax亚型可能完全不被抗A试剂识别,却能与抗AB(来自O型血清)发生微弱凝集,这种特性常导致将Ax型误判为O型。据统计,我国A2亚型误检率为0.3%-0.5%,而Ax型误检率高达5%-8%。
交叉配血试验的重要性在此凸显。当Aend亚型患者输入标准A型血液时,供血者红细胞表面的完整A抗原会与受血者血清中的抗A1抗体发生溶血反应。2019年某三甲医院曾报告一例Ax型产妇因误输A型血导致急性溶血,最终通过血浆置换抢救成功。此类案例提示,对于弱A亚型患者,必须采用更灵敏的唾液血型物质检测或分子生物学分型技术。
三、遗传学特征与种族分布
A型亚型的形成与ABO基因的多态性密切相关。基因测序显示,A1亚型对应IA1等位基因,其外显子7存在4个特异性单核苷酸多态性(SNP),而A2亚型的IA2等位基因在该区域有261delG突变,导致糖基转移酶活性下降80%。这种遗传差异解释了为何A2型个体与B型婚配可能产生O型后代——当父母分别携带IA2和i基因时,子代可能形成ii纯合体。
全球范围内,A1亚型占A型群体的80%以上,但在印度南部,A2亚型比例高达35%。我国汉族人群中A2型仅占A型人口的0.8%-1.2%,但在苗族、壮族等南方少数民族中,Ax亚型检出率显著升高,可能与古代楚苗族群基因渗透有关。这种地域分布差异为人类学研究和疾病流行病学调查提供了重要线索。
四、临床意义与研究进展
A型亚型与疾病易感性存在微妙关联。2020年《血液学杂志》研究指出,A1型人群感染诺如病毒的风险较A2型高3.2倍,这可能与病毒衣壳蛋白更易结合A1抗原的完整糖链结构有关。在肿瘤领域,A2亚型胃癌患者对奥沙利铂的敏感性显著高于A1型,5年生存率差异达18%。这些发现推动了个体化医疗的发展,部分医院已开始将血型亚型纳入化疗方案选择参考指标。
输血医学领域正经历技术革新。第三代血型检测芯片可同步识别ABO基因的12个SNP位点,将亚型误判率降至0.01%以下。基因编辑技术CRISPR/Cas9的应用试验显示,通过修复IA2基因的261delG突变,可在体外将A2型红细胞转化为A1型,这项突破有望解决稀有血型供血短缺问题。
从兰德斯坦纳发现ABO系统至今,人类对A型血的认识已从简单的血清凝集现象深入到分子遗传层面。A型亚型的精准识别不仅关乎输血安全,更与疾病机制、药物反应等生命科学重大问题紧密相连。未来研究需着重解决三方面问题:建立覆盖全亚型的中国人群基因数据库;开发快速廉价的床边检测技术;探索血型抗原在免疫调控中的新功能。唯有持续深化对血型系统的认知,才能充分发挥这一生物标志物在精准医学中的潜在价值。