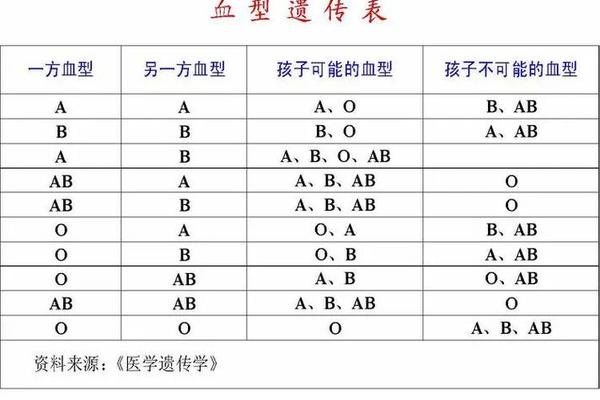
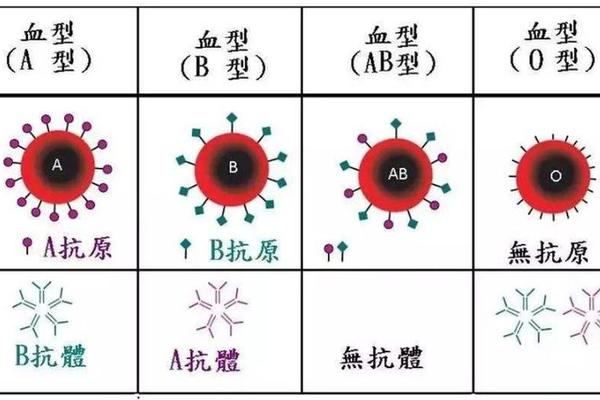
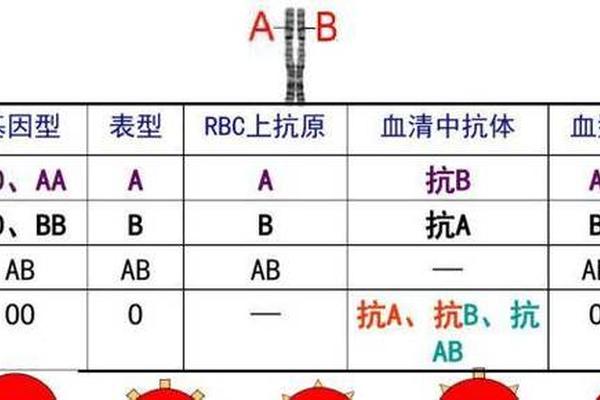
ABO血型系统是人类最早发现且临床应用最广泛的血型分类体系,其核心在于红细胞表面抗原的差异。A型血作为其中一种主要类型,其红细胞膜上携带A抗原,而血清中则存在抗B抗体。这一看似简单的生物学特性背后,涉及复杂的遗传机制、免疫学原理和临床意义。值得注意的是,许多人误认为A型血可能同时携带A抗原和抗A抗体,但科学事实与此截然相反——免疫系统通过精密的自我识别机制,确保不会攻击自身抗原。本文将系统解析A型血的抗原抗体特征,并探讨其在医学实践中的关键作用。
一、遗传机制决定抗原表达
A型血的形成根植于基因的调控机制。在ABO血型系统中,9号染色体上的IA、IB、i等位基因通过编码特定的糖基转移酶控制抗原合成。IA基因产物是α-1,3-N-乙酰半乳糖胺转移酶,这种酶能将N-乙酰半乳糖胺连接到前体物质H抗原的β-D-半乳糖末端,从而形成A抗原。当个体携带IAIA或IAi基因型时,其红细胞表面就会稳定表达A抗原,而i基因作为隐性等位基因无法编码功能性酶,因此O型血缺乏A、B抗原。
抗原表达的分子基础进一步揭示了其特异性。A抗原的化学结构是糖脂或糖蛋白复合物,其关键决定簇在于末端的N-乙酰半乳糖胺基团。研究发现,这种糖基化修饰不仅赋予抗原免疫原性,还影响红细胞膜表面电荷分布。值得注意的是,H抗原作为前体物质,在A型血中仍会残留部分未被修饰的结构,这解释了为何A型红细胞仍可检测到微量H抗原。
二、免疫耐受与抗体生成
免疫系统通过中枢和外周耐受机制确保不会对自身抗原产生抗体。A型血个体在胚胎发育阶段,胸腺中针对A抗原的淋巴细胞会经历阴性选择而被清除,形成免疫耐受。这种机制使得A型血血清中完全不存在抗A抗体,否则将引发致命性自身免疫性溶血反应。
抗B抗体的产生则源自天然免疫应答。出生后6-12个月内,肠道菌群和食物中的B类抗原类似物会刺激免疫系统,诱导B细胞分化为浆细胞并分泌IgM型抗B抗体。研究显示,这类天然抗体的效价与抗原暴露程度相关,例如长期素食者可能表现出更低的抗B抗体水平。值得注意的是,O型血个体因缺乏A、B抗原,血清中会同时存在抗A和抗B抗体,这与A型血的抗体特征形成鲜明对比。
三、亚型变异与检测挑战
A型血并非单一类型,目前已发现超过20种亚型,其中A1和A2亚型占99%以上。A1型红细胞同时表达A和A1抗原,而A2型仅表达A抗原且密度较低。这种差异源于基因突变导致的酶活性改变:A1转移酶能催化两种糖链的修饰,而A2转移酶仅作用于单一位点。血清学检测中,约1-2%的A2型个体会产生抗A1抗体,这可能导致交叉配血试验中的凝集反应。
弱表达亚型如A3、Ax等给临床检测带来挑战。这些亚型的红细胞与标准抗A试剂反应微弱甚至呈阴性,需通过吸收放散试验才能确认抗原存在。例如Ax型红细胞与O型血清中的抗AB试剂可发生凝集,但无法被普通抗A试剂识别,易被误判为O型。此类现象提示,在紧急输血或器官移植前,需采用分子生物学技术进行基因分型以规避风险。
四、临床实践中的双重意义
在输血医学中,A型血的抗原抗体特性具有关键指导价值。传统理论认为A型患者仅能接受A型或O型血液,但研究发现,A2亚型供血者的红细胞因抗原表达较弱,可安全输注给部分O型受血者。值得注意的是,O型血浆中的抗A抗体可能引发溶血反应,因此现代输血规范要求去除血浆成分或进行抗体效价测定。
近年研究还揭示了血型与疾病易感性的关联。2020年多中心研究显示,A型血人群感染新冠病毒的风险较O型血增加20%,可能与病毒S蛋白和抗A抗体的相互作用相关。在再生障碍性贫血领域,研究发现36%的A型患者存在HLA-A抗原表达缺失,这可能影响免疫抑制治疗疗效。这些发现提示,血型检测需纳入个性化医疗决策体系。
五、未来研究方向展望
目前对A亚型的分子机制研究仍存在空白,特别是Ax、Ael等罕见亚型的基因突变图谱尚未完全解析。利用单细胞测序技术追踪红细胞分化过程中的抗原表达动态,可能揭示亚型形成的时空调控规律。在临床应用层面,开发快速区分A亚型的床旁检测设备,将显著提升输血安全性和效率。
血型与免疫应答的关联机制值得深入探索。例如抗A抗体对新冠病毒的中和作用、A抗原在肿瘤免疫逃逸中的作用等,都可能为疾病防治提供新靶点。建立大规模血型-疾病关联数据库,结合人工智能进行多维度分析,将成为精准医学的重要发展方向。
ABO血型系统作为生命科学研究的经典模型,持续推动着免疫学、遗传学和临床医学的进步。A型血的抗原抗体特征不仅是生物学身份标识,更是连接基础研究与临床实践的桥梁。从基因调控到疾病易感性,从输血安全到个性化治疗,对A型血机制的深入理解将持续为人类健康提供关键科学支撑。未来研究需突破技术瓶颈,在分子互作网络和群体健康层面拓展认知边界,最终实现血型科学的价值转化。