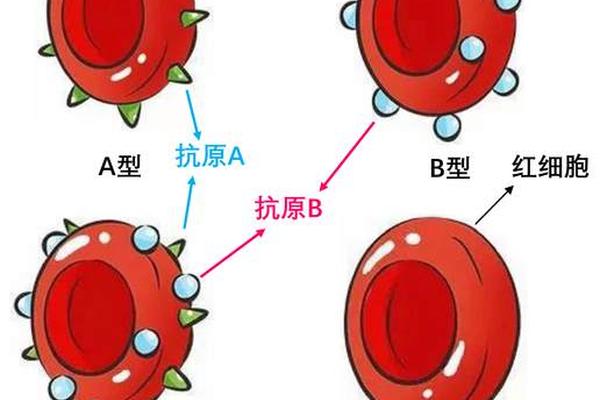
A型Rh阴性血型作为人类血型系统中的特殊存在,其匹配规则受到ABO和Rh双重血型系统的共同约束。ABO血型系统中,A型红细胞表面携带A抗原,血浆中含有抗B抗体;而Rh血型系统中,Rh阴性意味着红细胞缺乏D抗原。这种双重特性使得A型Rh阴性个体在输血、生育等场景中面临更复杂的免疫兼容性问题。根据国际输血协会数据,Rh阴性血型在亚洲人群中的占比不足1%,其稀缺性进一步加剧了临床匹配的难度。
从免疫学角度分析,A型Rh阴性受血者需要同时满足ABO相容和Rh阴性适配两个条件。ABO系统要求供血者红细胞不含有受血者血浆中的对应抗体攻击目标,而Rh系统则要求供血者红细胞不携带受血者已致敏的D抗原。例如,当A型Rh阴性患者输入B型Rh阳性血液时,不仅会触发ABO系统的抗B抗体攻击,还可能因D抗原引发Rh系统免疫反应。这种双重风险使得精准配型成为临床输血的核心原则。
输血兼容性的生物化学基础
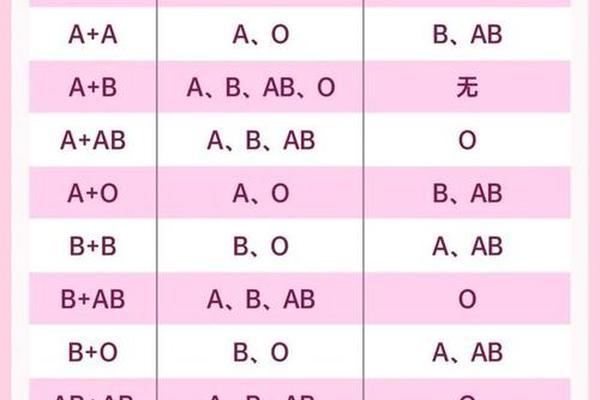
在ABO血型系统层面,A型Rh阴性个体仅能接受A型或O型血液。这是由于A型血浆中的抗B抗体会攻击B型或AB型红细胞表面的B抗原。值得注意的是,O型血虽被称为"万能供血者",但其血浆中同样含有抗A和抗B抗体。当O型全血输注给A型患者时,大量输入的抗A抗体会与受血者红细胞结合,造成溶血风险。因此现代临床输血更倾向使用去白膜层或洗涤红细胞,以降低抗体浓度。
Rh系统的复杂性体现在D抗原的免疫原性上。Rh阴性个体首次接触Rh阳性血液后,约70%会在两周内产生抗D抗体。这种免疫记忆使得二次接触Rh阳性血液时,抗体效价呈指数级增长,可能引发致命性的急性溶血反应。丹麦技术大学2024年的研究显示,通过嗜黏蛋白阿克曼菌提取的酶制剂,可将A型阳性红细胞转化为O型阴性,这种生物酶技术为突破Rh系统限制提供了新思路。
遗传规律与亲子血型关系
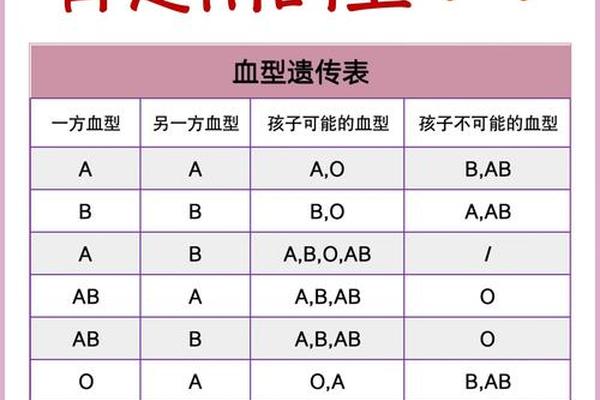
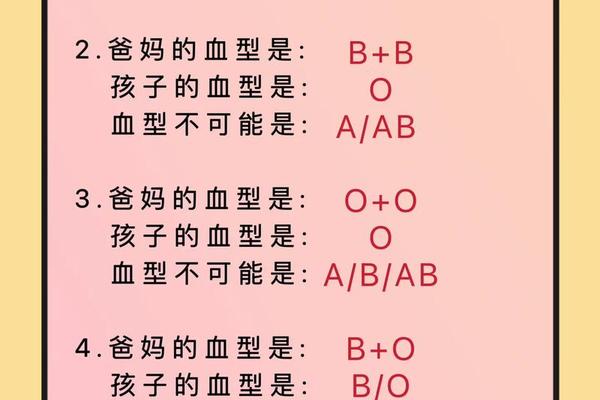
A型Rh阴性血型的遗传遵循ABO和Rh系统的独立遗传规律。在ABO系统中,A型基因型可能是AA或AO,当父母分别为A型和O型时,子女有50%概率继承AO基因型;若父母均为AO型,子女出现OO型(即O型)的概率达25%。Rh系统中,阴性表型由dd基因型决定,父母若均为Dd杂合子,子女有25%概率表现为dd型阴性。
临床上曾出现父母均为Rh阳性却生出Rh阴性子女的案例,这正是隐性遗传规律的具体体现。浙江大学附属儿童医院2022年收治的新生儿溶血症案例显示,父母ABO血型分别为A型和B型,但新生儿因遗传到父母双方的隐性d基因而表现为Rh阴性。这种跨系统的遗传独立性,使得血型鉴定必须采用多系统联合检测技术。

临床实践中的特殊应对策略
对于A型Rh阴性患者的紧急输血,我国《临床输血技术规范》建议采用"三步优先"策略:首先选择同型血液;次选O型Rh阴性红细胞;最后考虑O型Rh阳性红细胞(仅限男性或绝经女性)。武汉协和医院2022年的案例显示,某A型Rh阴性肺癌患者因产生抗E和类抗C抗体,最终通过稀有血型库匹配到ccdee型血液,这种精准配型需要依托包含数万份样本的稀有血型数据库。
在生育健康管理方面,Rh阴性孕妇需在妊娠28周和分娩后72小时内注射抗D免疫球蛋白。这种预防措施可将新生儿溶血发生率从17%降至0.1%以下。对于已致敏的孕妇,胎儿宫内输血技术可使严重溶血胎儿的存活率提升至85%以上,但需要具备分子血型诊断和超声引导穿刺等尖端技术支持。
未来发展与技术突破方向
血型转化技术正在改写传统配型规则。剑桥大学2022年成功将捐赠肾脏的血管内皮细胞血型转换为O型阴性,这项技术使器官移植的免疫排斥风险降低40%。基因编辑技术同样展现潜力,通过CRISPR-Cas9敲除ABO基因或插入FUT1基因,可定向改造造血干细胞的抗原表达谱。
人工智能在稀有血型匹配中的应用日趋成熟。武汉血液中心建立的智能配型系统,可将稀有血型检索时间从72小时压缩至15分钟,匹配准确率达99.8%。随着单细胞测序技术的发展,未来可能实现个体化红细胞定制,从根本上解决血源短缺问题。
本文系统阐述了A型Rh阴性血型的匹配机制与临床应对策略,揭示了多血型系统交互作用的复杂性。在生物技术飞速发展的今天,传统输血医学正与基因工程、人工智能深度融合。建议医疗机构加强稀有血型库建设,科研界继续探索血型转化的临床应用,公众则需提高对血型知识的认知,共同构建更安全高效的血液保障体系。