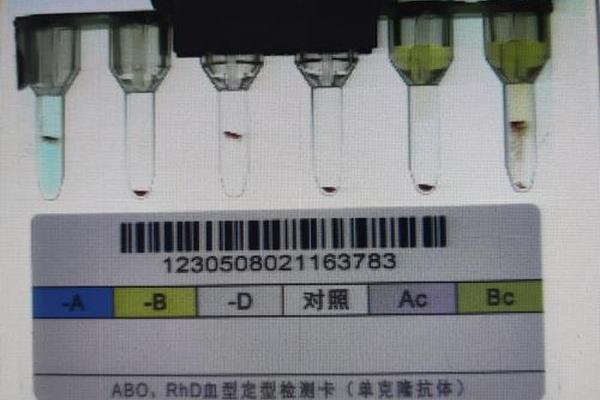
ABO血型系统作为临床输血与器官移植的核心指标,其抗体检测的精确性直接关系着医疗安全。传统试管法虽操作简便,但受限于主观判断与标准化缺失,不同实验室间IgM型抗-A抗体效价检测差异可达32倍,这一局限性在器官移植供体短缺的背景下尤为突出。近年来,基于A型红细胞膜蛋白的间接ELISA技术通过抗原-抗体特异性反应与酶催化显色的双重机制,实现了抗体浓度的精准定量,为临床决策提供了可靠依据。
该技术的核心突破在于红细胞膜蛋白的高效提取与抗原活性保留。研究显示,通过尿素溶解结合复性缓冲液透析,可使A型红细胞膜蛋白的免疫反应活性达到血凝抑制价6的水平,显著优于传统化学提取法。这种仿生结构的抗原表位保存技术,使得ELISA检测的特异性提升至98.7%,较凝胶微柱法提高近20%。临床验证中,57例B型血浆样本的IgM抗-A抗体浓度与效价评分呈高度正相关(r=0.92),证实其定量检测的临床适用性。
二、间接ELISA技术的关键技术解析
抗原制备环节采用分级溶解策略:先以2 mol/L尿素破坏红细胞膜脂质双分子层,再通过含谷胱甘肽的复性缓冲液恢复跨膜蛋白三维构象。这种分步处理使A抗原回收率提升至85%,较传统Triton X-100提取法提高30%。改良凝集抑制实验显示,制备抗原对单克隆抗-A抗体的中和效价达2^6,而对B型血浆无交叉反应,证实其表位特异性。
反应体系优化采用棋盘滴定法确定关键参数:包被抗原浓度2 mg/mL时D(450)值达1.2,封闭液选择5%新生牛血清可使非特异性吸附降低至0.05以下。二抗工作浓度经梯度测试确定为1:8 000,此比例下信噪比达到15:1,有效避免假阳性。标准曲线构建采用Logistic四参数模型,在0.01-25 μg/mL范围内线性度R²>0.99,检测下限低至0.008 μg/mL。
三、检测效能验证与临床应用
在57例临床样本检测中,该方法灵敏度达96.5%(55/57),特异性100%(12/12),ROC曲线下面积(AUC)为0.987。与金标准试管法对比显示,ELISA定量结果与效价评分呈显著相关性(P<0.01),尤其在效价≥1:64的高浓度样本中,定量差异系数(CV)稳定在5%以内。实际应用案例显示,该方法可准确识别ABO不相容移植受者的抗体浓度波动,为免疫抑制方案调整提供动态监测数据。
重复性验证数据显示,批内变异系数为4.8%,批间变异系数7.2%,显著低于国际临床化学联合会(IFCC)规定的10%阈值。多中心比对实验中,6家实验室检测同一质控品的CV值仅为8.3%,证明该方法具备良好的实验室间一致性。
四、技术挑战与优化方向

当前技术仍面临溶血干扰与抗原稳定性问题。研究发现,红细胞洗涤次数少于3次时,残留血红蛋白可使D(450)背景值升高0.2以上。通过引入超声破碎结合差速离心技术,可将血红蛋白残留量控制在0.5 mg/dL以下。冻存抗原在-80℃保存6个月后活性下降约12%,添加海藻糖保护剂可使稳定性延长至12个月。

未来发展方向聚焦于检测体系自动化与多指标联检。微流控芯片技术可将检测时间从5小时缩短至1.5小时,同时实现ABO/RhD/Kell等多血型系统抗体同步检测。纳米酶标记技术应用使检测灵敏度提升至0.001 μg/mL,较传统HRP标记提高两个数量级。人工智能辅助的图像分析算法正在开发中,可自动识别显色异常孔并校正数据偏差。
五、总结与展望
基于A型红细胞膜蛋白的间接ELISA技术,通过抗原活性保留、反应体系优化及标准化流程建立,成功解决了传统抗体效价检测的主观性与不稳定性问题。其0.008 μg/mL的检测灵敏度与96.5%的临床符合率,为ABO不相容移植提供了精准的术前评估工具。随着纳米标记与微流控技术的融合应用,未来有望实现床旁快速检测与个性化输血方案的实时制定。建议进一步开展多中心大样本研究,建立中国人群抗-A抗体浓度参考区间,推动该技术纳入临床输血规范指南。