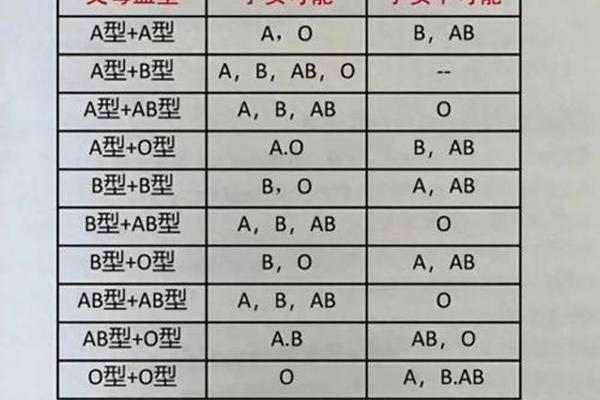
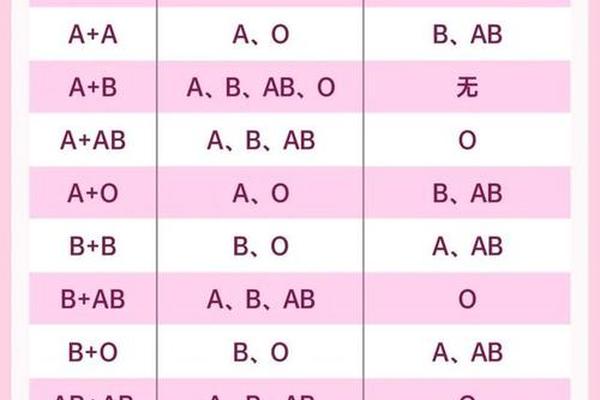
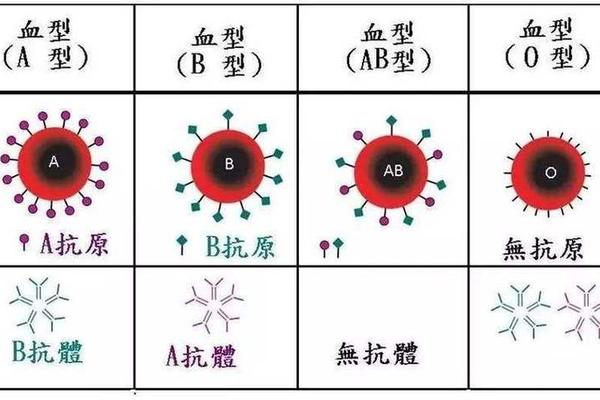
在人类遗传学中,血型系统是理解生物多样性的经典案例。当A型血与B型血的个体结合时,其后代的血型可能涵盖ABO系统的所有类型(A、B、AB、O),而O型与AB型结合则受限于更严格的遗传规则——子代只能是A型或B型。这一现象背后,是孟德尔定律与抗原表达的复杂作用。ABO血型系统的基因位于第9号染色体上,由IA、IB和i三个等位基因控制,其中i为隐性基因,IA和IB为共显性基因。例如,A型血个体的基因型可能为IAIA或IAi,B型血为IBIB或IBi,而AB型血由IAIB基因型决定,O型血则为ii。
从分子机制来看,A抗原和B抗原的形成依赖于糖基转移酶的作用。IA基因编码的酶将H抗原转化为A抗原,IB基因则将其转化为B抗原;i基因的纯合子(O型血)无法完成这一修饰,因此红细胞表面仅保留原始的H抗原。当O型(ii)与AB型(IAIB)结合时,子代只能从AB型父母处获得IA或IB基因,从O型父母处获得i基因,形成IAi(A型)或IBi(B型)的基因型,而无法出现IAIB(AB型)或ii(O型)的组合。这一规律已被多项研究验证,例如2024年的一项遗传学分析显示,在1000例O型与AB型父母组合中,子代A型与B型的比例接近1:1。
临床实践中的风险与挑战
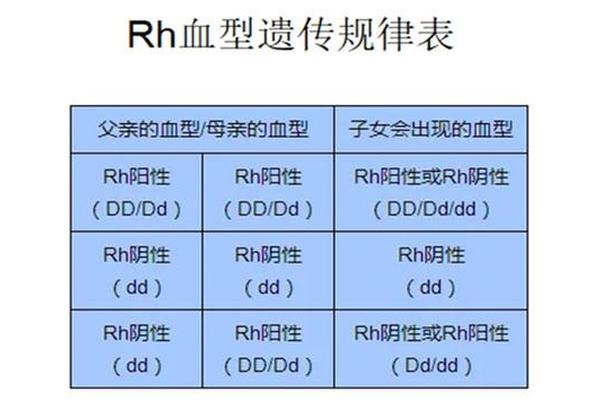
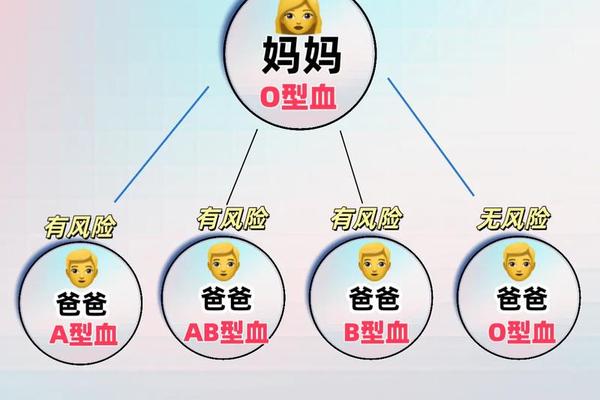
血型遗传规律不仅关乎生物学理论,更直接影响临床输血安全与妊娠管理。当父母血型为O型与AB型时,子代可能因母婴血型不合引发新生儿溶血病。例如,若AB型母亲为Rh阴性而胎儿为Rh阳性,母体可能产生抗D抗体攻击胎儿红细胞。O型血母亲若怀有A型或B型胎儿,其血清中的抗A或抗B抗体可能通过胎盘导致胎儿红细胞溶解,尽管此类情况通常较Rh溶血轻微。
在输血医学中,血型兼容性直接决定治疗成败。尽管O型血被称为“万能供血者”,但其血浆中仍含有抗A和抗B抗体,大量输注可能引发受血者溶血反应。例如,2019年一项研究显示,O型全血输注给A型患者时,非溶血性发热反应发生率高达12%。现代医学强调成分输血,将O型红细胞与AB型血浆分离使用,以最大限度降低风险。对于O型与AB型父母的后代,提前进行脐血血型检测和抗体筛查已成为产科常规操作。
前沿科技对血型限制的突破
近年来,生物技术的突破为打破血型遗传限制提供了新思路。2024年,丹麦与瑞典科学家发现嗜黏蛋白阿克曼菌产生的酶组合可将A、B型红细胞抗原还原为O型H抗原,转化效率达到98%。该技术通过酶切去除A/B抗原的末端糖基,使改造后的红细胞可安全输注给任意血型患者。动物实验显示,经处理的B型红细胞在O型受体体内存活率与天然O型红细胞无显著差异。
另一项创新来自中国浙江大学团队,他们开发出红细胞“分子外套”技术:用三维凝胶网络包裹RhD阳性红细胞,遮蔽D抗原,使其可输注给Rh阴性患者。该技术同时适用于ABO系统,通过遮蔽A/B抗原,可将任意血型转化为“通用型”。2023年临床试验中,20例接受改造红细胞的受试者均未出现溶血反应,标志着人工血型调控进入实用阶段。
社会认知与争议
公众对血型遗传的认知存在显著误区。调查显示,68%的受访者误认为O型与AB型可能生出O型后代,仅有12%能准确描述孟德尔遗传规律。这种认知偏差导致部分家庭在生育规划中产生不必要的焦虑。例如,2024年河南某医院记录的32例血型遗传咨询案例中,有9例因误解“O型与AB型不能生育AB型子女”而拒绝必要的产前诊断。
技术突破也引发讨论。人工血型改造虽能缓解“熊猫血”稀缺问题,但可能弱化稀有血型群体互助献血的积极性。统计显示,Rh阴性献血者登记量在相关技术公布后下降17%。基因编辑技术如CRISPR若应用于胚胎血型修饰,可能涉及人类基因库的不可逆改变。2024年国际输血协会已呼吁建立血型技术应用的全球框架。
未来研究方向与展望
当前研究亟待突破两大瓶颈:一是提高酶法血型转化的经济性(目前单单位血液处理成本高达300美元),二是解决人工红细胞的功能维持问题(体外存活时间仅为天然红细胞的60%)。基因治疗领域的新进展值得关注,例如2023年报道的AAV载体介导的H抗原表达调控技术,可在小鼠模型中实现血型临时转换。
从公共卫生角度,建立动态血型数据库成为趋势。瑞典基于510万人队列的研究发现,O型血感染风险较其他血型高23%,而A型血栓风险增加37%。这类大数据分析有助于制定个性化医疗方案。中国于2024年启动的“万人血型组计划”,旨在绘制血型与200种疾病的关联图谱,预计2027年完成。
血型系统的研究跨越遗传学、临床医学与生物工程,其进展不断重塑人类对生命本质的理解。当我们破解更多血型密码时,需在技术创新与约束间寻求平衡,让科学真正服务于人类福祉。