血液是人类生命活动的重要载体,其复杂的分型系统承载着免疫防御与遗传信息的双重密码。在ABO与Rh两大血型体系中,A型血人群因其抗原分布的特殊性,被进一步划分为A+(Rh阳性)与A-(Rh阴性)。这种区分不仅关系到输血治疗的精准性,更与器官移植、新生儿健康等生命攸关的医疗实践密不可分。如何通过科学手段准确鉴定ABO血型中的A抗原,并同步检测RhD抗原的存在与否,成为现代医学保障临床安全的核心课题。
ABO血型抗原的鉴定原理
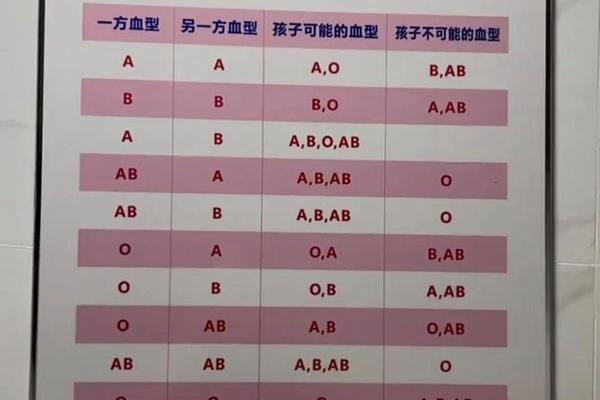
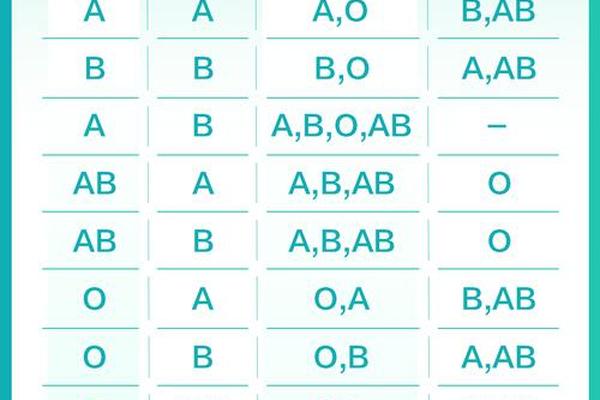
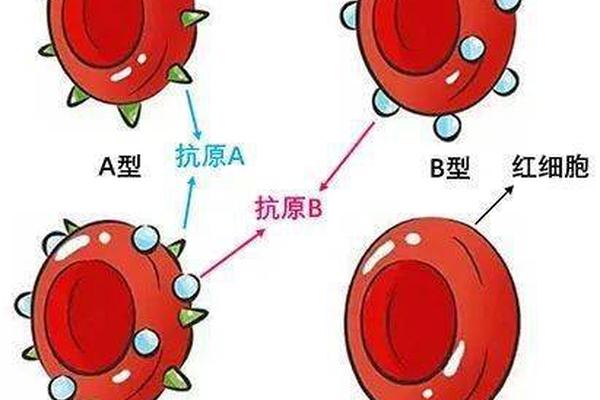
ABO血型系统的核心在于红细胞表面A、B抗原的分布。根据抗原类型,人类被划分为A型(含A抗原)、B型(含B抗原)、AB型(A和B抗原共存)及O型(无A/B抗原)。对于A型血的鉴定,需通过血清学试验进行正反定型双重验证:正向定型使用抗A血清检测红细胞表面A抗原,反向定型则通过A型标准红细胞检测血清中是否含有抗B抗体。
在正向定型中,抗A单克隆抗体与A抗原结合会引发红细胞凝集,通过肉眼或显微镜观察凝集强度判断结果。例如,试管法通过离心加速抗原抗体反应,能在3分钟内完成高灵敏度检测,尤其适用于急诊场景。反向定型则要求受检者血清与已知的A型标准红细胞发生凝集反应,若未出现凝集则需警惕抗体效价过低或亚型干扰。两种方法的联合应用可将ABO血型误判率降至0.01%以下。
RhD抗原的检测路径
Rh血型系统中,D抗原的存在与否决定了Rh阳性(+)或阴性(-)的划分。对于A型血而言,区分A+与A-的关键在于RhD抗原的检测。由于Rh抗体多为IgG型,无法在盐水介质中直接凝集,临床多采用酶处理法或抗球蛋白试验。
酶介质法通过木瓜酶破坏红细胞膜唾液酸,暴露隐蔽的D抗原表位,增强抗D抗体与抗原的结合能力。该方法对弱D变异型的检出率可达95%,但需严格设置阳性和阴性对照以避免假阳性。凝胶微柱技术则利用葡聚糖凝胶的分子筛效应,通过离心后红细胞在凝胶柱中的沉降位置判断凝集程度,实现标准化操作与自动化判读,特别适用于血站大规模筛查。值得注意的是,约0.1%的亚洲人群携带部分D抗原(如DVI型),需通过基因测序确认其输血相容性。
区分A+与A-的临床意义

Rh阴性个体接受Rh阳性血液后,约70%会产生抗D抗体,二次输血时将引发急性溶血反应。A-患者必须严格输注A-血液,而A+患者则可兼容A+或A-血液。在产科领域,Rh阴性孕妇若怀有Rh阳性胎儿,胎儿的红细胞可能通过胎盘进入母体,刺激母体产生抗D抗体,导致后续妊娠的新生儿溶血病。通过产前RhD筛查与抗D免疫球蛋白预防性注射,可将其发生率从16%降至1%以下。
流行病学数据显示,我国汉族人群中Rh阴性比例不足0.5%,而欧美人群可达15%。这种差异使得A-血液成为稀缺资源,血库需建立动态监测机制,确保紧急情况下的血液供应。2018年上海血液中心的统计显示,Rh阴性血液的报废率是Rh阳性的3倍,凸显精准库存管理的重要性。
技术挑战与未来方向
传统血清学方法面临亚型干扰(如A2亚型)、抗体效价波动等技术瓶颈。分子生物学技术的引入为血型鉴定带来突破:PCR-SSP可特异性扩增ABO基因外显子6-7的关键位点,准确识别A101/A102等亚型;Sanger测序则能解析罕见的B(A)嵌合等位基因。基因编辑技术的进步甚至使体外诱导多能干细胞分化为特定血型红细胞成为可能,为稀有血型患者提供新型血源。
自动化设备的普及显著提升检测效率。全自动血型分析仪整合微柱凝胶技术与图像识别系统,每小时可处理200份样本,并将人工误差率从0.8%降至0.05%。基层医疗机构仍面临设备短缺与操作标准化不足的挑战。2024年国家卫健委发布的《血型鉴定操作指南》强调,必须通过双人复核、定期质控来保障结果准确性。
血型系统的复杂性映射着人类免疫系统的精妙进化。从血清凝集试验到基因测序,技术的迭代始终围绕着精准医疗的核心诉求。A+与A-的区分看似简单,实则牵动着输血安全、母婴健康、司法鉴定等多重社会系统。未来研究应聚焦于三方面:一是开发便携式快速检测设备,提升基层医疗应急能力;二是建立区域性稀有血型动态数据库,优化血液资源配置;三是探索通用型红细胞改造技术,从根本上突破血型屏障。唯有将技术创新与临床需求深度耦合,才能筑牢生命保障的基石。