在人类复杂的生命体系中,血型始终是医学领域最具标志性的身份标签之一。当我们在体检报告上看到"A-"的标识时,这简短的符号背后蕴含着两个关键的血型系统信息——ABO系统中的A型血与Rh系统中的Rh阴性特征。这种特殊的组合不仅决定了输血医学中的生命密码,更在全球人口中仅占约0.3%的罕见比例,使其成为名副其实的"血色瑰宝"。理解A-型血型的生物学本质和临床意义,对保障输血安全、推动精准医疗发展具有重要价值。
双系统叠加的血型密码
A-型血型的定义建立在对ABO和Rh两大血型系统的双重识别基础之上。在ABO系统中,A型血的红细胞表面携带A抗原,血浆中则存在抗B抗体。这种抗原-抗体的特殊配置源于第九号染色体上的基因表达,当个体遗传到至少一个A基因(显性)时即表现为A型血型。而Rh系统中的阴性特征则意味着红细胞表面缺乏D抗原,这种特性由第一号染色体上的RHD基因缺失或突变导致。
基因测序技术的进步揭示了更复杂的亚型差异。例如A型血中存在A1和A2亚型,前者红细胞同时携带A和A1抗原,后者仅有A抗原。近年复旦大学团队更发现了全球首例Ael亚型,其抗原表达极其微弱,常规检测极易误判为O型血。这些发现提醒我们,血型鉴定已从简单的血清学检测迈入分子诊断时代。
遗传规律与种群分布
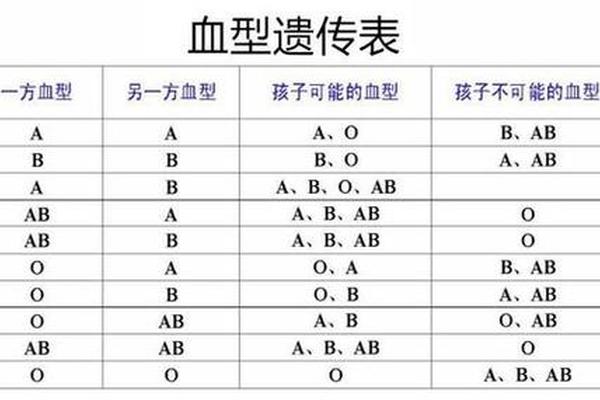
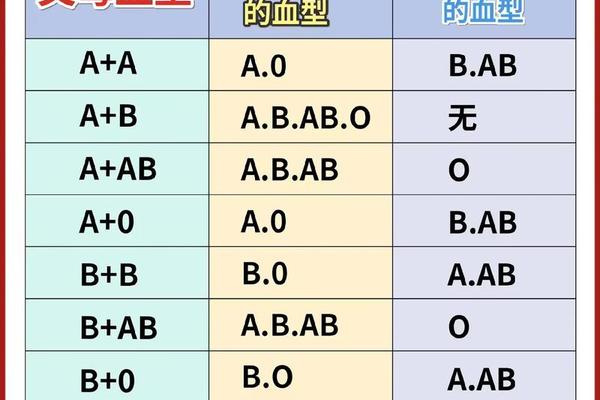
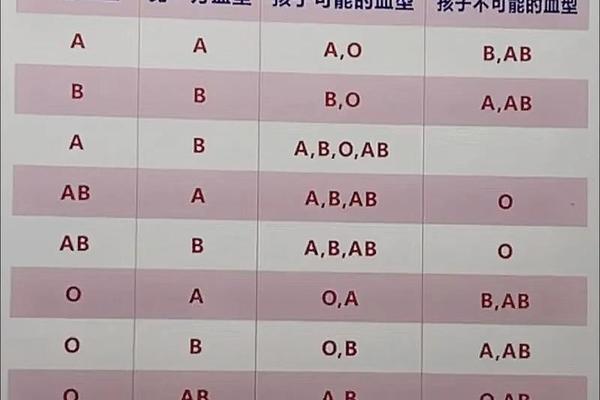
A型血的遗传遵循孟德尔定律。当父母均为A型时,子代可能携带AA或AO基因型,表现为A型或O型。Rh阴性特征则属于隐性遗传,只有当双亲均传递隐性基因时才会表现。这种遗传特性导致Rh阴性血型在亚洲人群中仅占0.3%-0.5%,显著低于白种人15%的比例。
全球血型数据库显示,A-型血型的分布呈现明显地域差异。在东亚地区,由于ABO系统中B型血比例较高,A-型血型约占总人口0.1%,而北欧国家这一比例可达0.7%。这种差异可能与历史上的自然选择相关——有研究表明A抗原对某些病原体具有天然抵抗力,在特定疫病流行区域具有生存优势。
临床输血的双重挑战
在输血医学实践中,A-型血型面临ABO和Rh系统的双重限制。其红细胞只能输给A型或AB型的Rh阴性受血者,而血浆制品则需避免含有抗B抗体对B型或AB型受血者造成溶血反应。更复杂的是,约26%的A2亚型个体会产生抗A1抗体,若误输A1型血液可能引发严重输血反应。
紧急输血时的替代方案需要谨慎权衡。理论上可选用O-型红细胞或A-型血浆,但前者存在库存紧张问题,后者则有抗体滴度超标风险。2024年丹麦科学家在《自然·微生物学》发表的突破性研究显示,通过嗜黏蛋白阿克曼菌提取的酶组合,可将A型血转化为通用型O型,这为缓解稀有血型危机提供了新思路。
健康管理的特殊需求
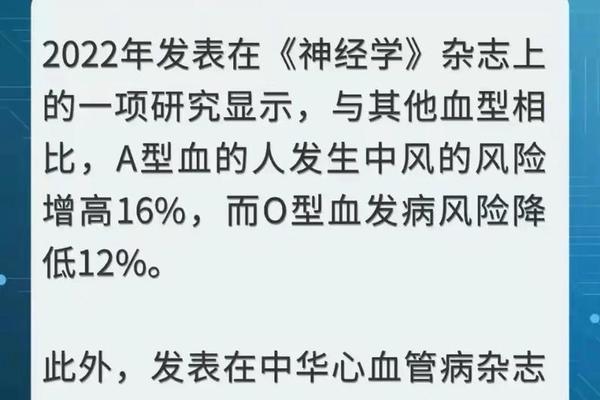
近年研究提示血型与疾病易感性存在微妙关联。武汉金银潭医院2020年的数据显示,A型血患者感染新冠肺炎的风险较O型血增加45%。虽然其机制尚未完全阐明,但可能与A抗原介导的病毒吸附增强有关。对于A-型血人群,这种风险叠加稀有血型的医疗特殊性,使得定期健康监测尤为重要。
在生育健康领域,Rh阴性孕妇需特别注意胎儿溶血风险。当父亲为Rh阳性时,胎儿可能遗传显性RHD基因,引发母体产生抗D抗体攻击胎儿红细胞。现代产前诊断技术可通过游离胎儿DNA检测,在孕早期实现Rh血型无创鉴定,为及时进行抗D免疫球蛋白干预提供依据。
社会支持与未来展望
建立区域性稀有血型库已成为全球共识。我国自2018年起实施的《稀有血型应急供血预案》,通过DNA数据库和冷冻保存技术,已将A-型血的应急响应时间缩短至72小时。个人层面的自体储血也值得推广,研究表明术前2-4周采集的400ml自体血即可满足多数手术需求,且能避免异体输血风险。
基因编辑技术为血型转化带来新可能。CRISPR-Cas9系统已在小鼠实验中成功实现RHD基因敲除,将Rh阳性转为阴性。若结合ABO基因编辑,未来或可实现跨血型改造。但审查和技术安全性仍是亟待突破的瓶颈,需要科研工作者与委员会共同探索合理的技术应用边界。
当我们凝视"A-"这个血色符号时,看到的不仅是基因编码的生命印记,更是人类对抗疾病、守护生命的智慧结晶。从Landsteiner发现ABO血型获得诺贝尔奖,到今日的基因编辑突破,对稀有血型的探索永无止境。未来研究应着重于:建立全球联动的稀有血型数据库,开发更精准的亚型检测技术,完善基因治疗框架。唯有如此,才能让每个特殊血型个体都能获得平等的生命保障。