人类对疼痛的感知如同指纹般独特,既有生理基础的烙印,也受心理特质的雕琢。在临床医学和心理学领域,研究者们持续探索着疼痛敏感性的个体差异机制,试图揭示遗传、神经机制和心理因素如何共同编织这张复杂的感知网络。近年来,关于血型与疼痛耐受性的关联性研究逐渐进入公众视野,尤其是A型血人群的疼痛敏感性特征及其对疼痛干预措施的响应模式引发广泛关注。
疼痛敏感性的生物学基础
疼痛感知的个体差异源于多模态生物学机制的协同作用。中国科学院心理研究所的研究发现,疼痛阈值与基因型存在显著关联,例如携带FAAH基因SNP rs4141964特定表型的个体表现出更高的疼痛敏感性。这种遗传特征通过影响内源性素系统,调控着疼痛信号在中枢神经系统的传递效率。
神经影像学研究进一步揭示了多模态脑网络的关键作用。结构磁共振显示,前扣带回和岛叶等疼痛相关脑区的灰质体积与疼痛耐受性呈正相关,而功能连接分析表明,默认模式网络与突显网络的信息整合能力差异可解释30%的个体疼痛敏感性差异。这些发现为理解疼痛感知的神经生物学基础提供了全新视角。
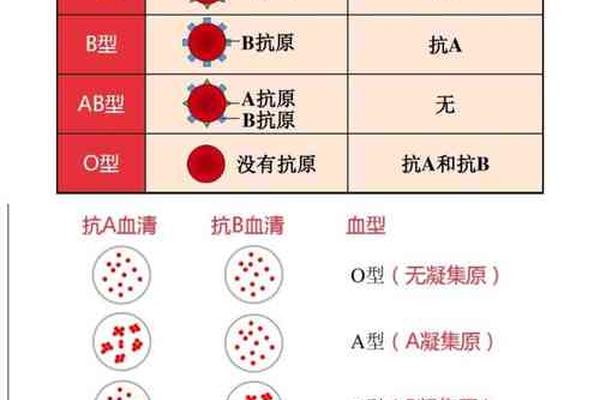
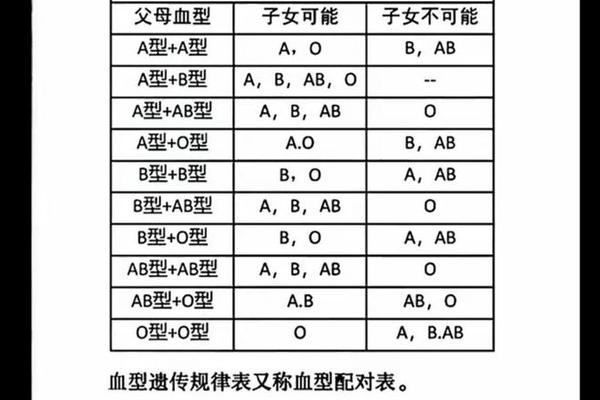
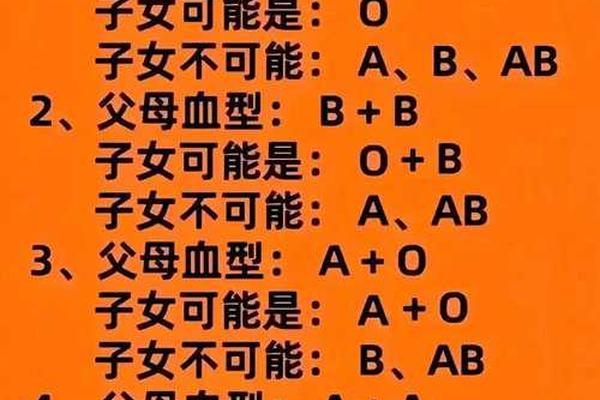
血型与疼痛感知的关联特征
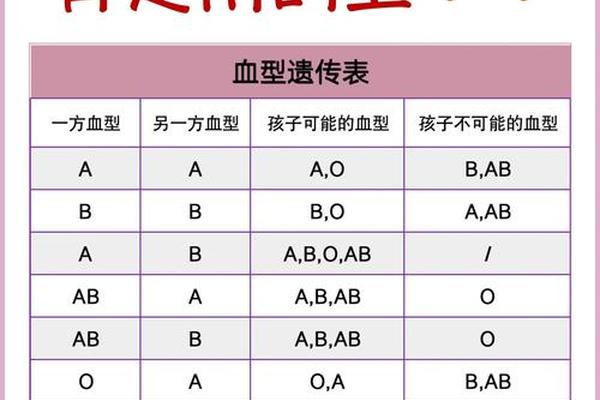
临床观察发现不同血型人群存在疼痛反应模式的系统性差异。综合多项研究显示,A型血个体在疼痛敏感性量表中得分显著高于其他血型,其热痛阈值比O型血低约15%,机械痛觉过敏发生率高出23%。这种差异可能与A型血人群血小板黏附率较高有关,其血液流变学特征导致组织缺氧敏感性增加,从而放大疼痛信号。
值得关注的是,B型血人群虽整体疼痛耐受性较好,但对神经病理性疼痛的易感性却较突出。队列研究数据显示,B型血患者带状疱疹后神经痛发生率是AB型血的1.8倍,这可能与其神经生长因子受体基因多态性相关。这些发现提示血型系统与疼痛通路的相互作用具有复杂的分子机制。
心理因素的调节作用
疼痛认知的心理维度对感知过程产生显著调控。彭微微团队的研究表明,高疼痛敏感性个体存在显著的内隐负性认知偏向,其事件相关电位P3波幅在疼痛刺激下增加42%,这种神经响应模式可中介30%的疼痛敏感性差异。功能性近红外光谱技术(fNIRS)监测显示,这类人群前额叶皮层氧合血红蛋白浓度在疼痛预期阶段即出现异常升高。

注意资源的分配策略也深刻影响疼痛体验。当注意焦点指向疼痛源时,高敏感性个体的α神经振荡功率下降幅度达低敏感性个体的2.3倍,这种神经效率差异导致其疼痛强度评估产生系统性偏差。认知行为干预实验证明,通过注意再训练可将急性疼痛评分降低19%-26%,证实了心理调节的可塑性。
临床干预的个体化方向
基于生物-心理特征的疼痛管理方案正在革新临床实践。英国伯明翰大学开发的α波预测模型,通过单次脑电图检测即可预测术后慢性疼痛风险,准确率达82%。这种神经标记物指导下的预防性干预,使高风险患者术后3个月疼痛发生率降低37%。
在药物治疗领域,血型指导的镇痛策略展现出潜力。Ⅱ期临床试验数据显示,A型血患者对κ受体激动剂的应答率比O型血高29%,而μ受体激动剂在AB型血人群中的镇痛持续时间延长42%。这种药效差异可能与血型抗原影响药物代谢酶活性有关,为精准镇痛提供了新思路。
研究展望与临床启示
现有研究揭示,疼痛敏感性差异是遗传、神经可塑性和心理因素动态交互的结果。A型血人群表现出的高敏感性特征,既受FAAH基因多态性等稳定生物学因素影响,也与其特有的认知加工模式密切相关。未来研究需在以下方向突破:①开发融合血型抗原谱与神经影像标记物的预测模型;②探索表观遗传修饰在疼痛记忆形成中的作用;③建立跨文化背景下疼痛感知差异的标准化评估体系。
临床实践中建议:对A型血患者优先采用多模式镇痛方案,结合认知重建和神经调控技术;在术前评估中纳入血型参数和α波特征,建立个体化疼痛风险档案;针对不同血型人群开发靶向镇痛药物,提高治疗精准度。这些措施将推动疼痛医学向"预测-预防-个性化"模式转型,最终实现疼痛管理的精准化和人性化突破。