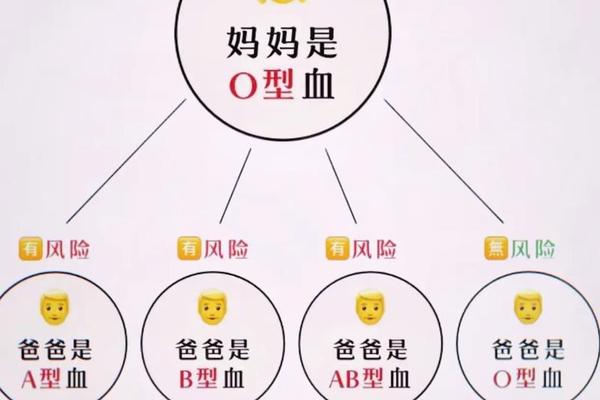
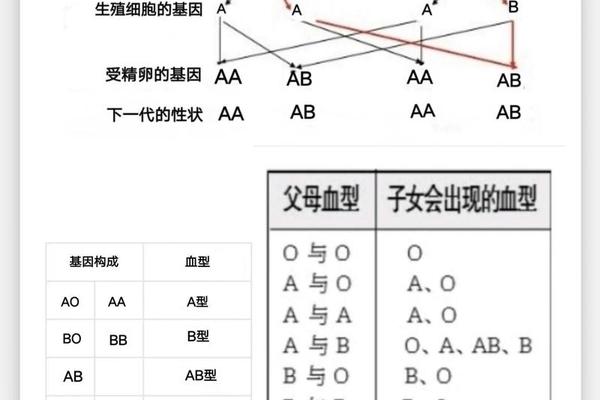
在传统认知中,A型血常被简化为单一类别,但现代医学研究揭示了其复杂的亚型系统与Rh因子的叠加效应。A型血不仅包含ABO血型系统中的A1、A2、Ax等亚型,还与Rh血型系统中的阳性(+)或阴性(-)形成交叉组合,如A+、A-等。这种双重分类体系直接关系到输血安全、妊娠并发症乃至疾病易感性。例如,A2型RH-个体的血清可能含有抗A1抗体,而A1型RH+的抗原表达强度显著高于其他亚型,这种差异导致不同亚型间的输血存在严格限制。
从分子生物学角度看,A抗原的形成依赖于糖基转移酶的作用:A1亚型的红细胞表面同时存在A和A1抗原,而A2亚型仅有A抗原。这种差异源于ABO基因的突变,导致酶活性的不同。更罕见的Ael亚型则表现为抗原表达极弱,常规检测可能误判为O型,需通过吸收放散试验等特殊手段鉴定。Rh因子作为独立于ABO系统的另一维度,其D抗原的存在(Rh+)或缺失(Rh-)进一步细分了A型血的临床价值。我国汉族人群中Rh-仅占0.3%-0.4%,这使得A-型成为比“熊猫血”更稀缺的医疗资源。
二、输血医学中的致命差异
在临床输血实践中,A型亚型与Rh因子的组合差异可能引发致命风险。A1型红细胞与A2型血清接触时,会因A2血清中的抗A1抗体诱发凝集反应。2011年的研究数据显示,A1与A2亚型误输导致的溶血反应死亡率可达15%,这与ABO主型不合的致死率相当。更复杂的是Ax亚型,其与B型血清不凝集但能被O型血清识别,若误判为O型将导致灾难性后果。2024年厦门发现的全球首例Ael亚型更凸显亚型鉴定的必要性——该个体在常规检测中违反“兰德斯特定律”,血浆与红细胞抗原呈现矛盾特征。
Rh因子的影响同样深远。A+型可接受同型或A-型血液,但A-型若误输Rh+血液,首次可能无反应,却会刺激机体产生抗D抗体。二次输血时将引发严重溶血,这在妊娠女性中可能造成胎儿核黄疸。研究显示,Rh-产妇输入Rh+血液后,新生儿溶血症发生率提高8倍,这促使现代血库对Rh因子筛查的精度要求达到10^-6级别。
三、基因解码与疾病易感性
基因测序技术揭示了ABO亚型与Rh因子的遗传奥秘。A1亚型由ABO A1等位基因控制,其编码的糖基转移酶活性是A2型的3倍;而Ael亚型涉及内含子剪切位点突变,导致转录本异常。Rh阴性表型则源于RHD基因纯合缺失或突变,全基因组关联研究发现,RHD基因与VWF因子表达呈负相关,这解释了Rh-个体血栓风险较低但出血倾向较高的临床现象。
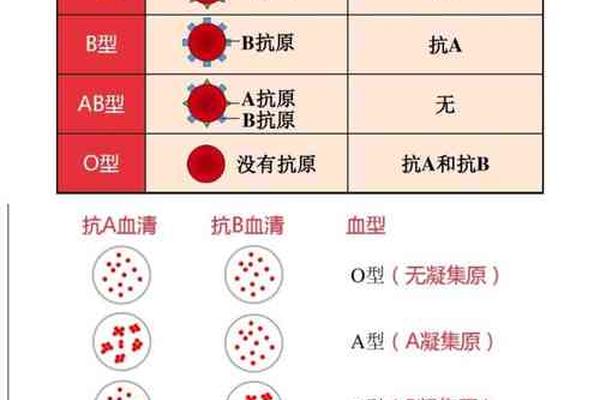
疾病易感性方面,A型血人群展现出独特的风险图谱。A抗原与幽门螺杆菌粘附蛋白的亲和力导致胃癌风险增加40%,而A2亚型因抗原密度较低,相关风险降至28%。在妊娠领域,A+型孕妇发生静脉血栓栓塞的风险是非O型血的1.5倍,但A-型因VWF水平较低,子痫前期发生率显著降低。值得注意的是,Ax亚型个体因免疫应答异常,被发现有更高的自身免疫性疾病易感性。
四、未来医学的挑战与机遇
罕见血型的发现推动着检测技术的革新。第三代测序技术已能识别ABO基因第7外显子的单核苷酸多态性,使Ax亚型的确诊时间从72小时缩短至6小时。基因编辑技术则为人工改造血型带来可能:2023年《自然·医学》报道,通过CRISPR敲除FUT1基因,成功将A型红细胞转化为通用O型,这为缓解血源短缺提供了新思路。
在临床应用层面,建立全国性稀有血型数据库迫在眉睫。厦门Ael亚型的发现者吕小英团队建议,应采用微流控芯片技术实现ABO-Rh-Kell等多系统同步检测,并将检测灵敏度提升至0.01%抗原浓度。对于A-型等稀有血型,开展自体血冷冻保存和干细胞定向分化技术,将成为保障输血安全的关键策略。
<总结>

从A1到Ael的亚型谱系,从Rh+到Rh-的免疫鸿沟,A型血的复杂性远超传统认知。这种差异不仅决定了输血配型的生死界限,更与疾病发生、妊娠结局乃至个体化医疗紧密相关。随着Ael等新亚型的发现,我们意识到血型系统的多样性可能只是冰山一角。未来研究需在基因编辑、稀有血型库建设、多组学联合分析等领域持续突破,方能在生命密码的迷宫中,为人类健康开辟更安全的路径。建议临床机构强化亚型检测能力,普通民众也应通过精准血型鉴定,为可能出现的医疗需求做好准备。