类A血型物质是ABO血型系统中与A型抗原高度相似的一类糖蛋白复合物,其核心结构由H抗原前体连接N-乙酰半乳糖胺残基构成。根据ABO血型分类标准,红细胞表面表达A抗原的个体被定义为A型血,其血浆中天然存在抗B抗体。类A物质的出现可能打破这一传统分类逻辑。例如,在白血病或恶性肿瘤患者中,病理细胞分泌的类A物质可吸附于红细胞表面,导致血型鉴定时呈现A型特征,但实际基因型可能并非A型。
从分子机制来看,类A物质与标准A抗原的区别在于其糖链修饰的完整性和稳定性。研究表明,A抗原的合成依赖于Hh基因编码的α-1,2-岩藻糖基转移酶,而类A物质可能因H抗原前体合成受阻或糖基转移酶活性异常,形成结构不完整的类抗原。这种差异在血型血清学检测中表现为凝集强度的显著减弱,例如在老年患者群体中,A抗原表达水平可能因代谢衰退下降至传统检测方法的判定阈值以下,从而被误判为O型血。
二、临床血型鉴定中的特殊挑战
在常规血型检测中,类A物质的存在可能导致正反定型矛盾。例如某79岁腰椎骨折患者案例显示,其红细胞经三次洗涤后正定型凝集强度仅为微弱阳性(1+),而反定型中抗B抗体呈现强反应(4+),最终修正诊断为A型血。这种现象源于类A物质与标准抗A试剂的亲和力差异:完整的A抗原可引发4+凝集反应,而结构异常的类A物质仅能触发1+反应,易被误判为O型或亚型。
此类误判风险在特定病理状态下尤为突出。例如多发性瘤患者体内过量产生的异常免疫球蛋白,可能通过空间位阻效应遮蔽红细胞表面抗原;造血干细胞移植后嵌合体形成阶段,供者与受者红细胞群共存,可能呈现混合视野凝集现象。临床建议采用微柱凝胶卡技术增强检测灵敏度,并结合分子生物学检测(如PCR-SSP)验证基因型。
三、遗传学与病理学交叉机制
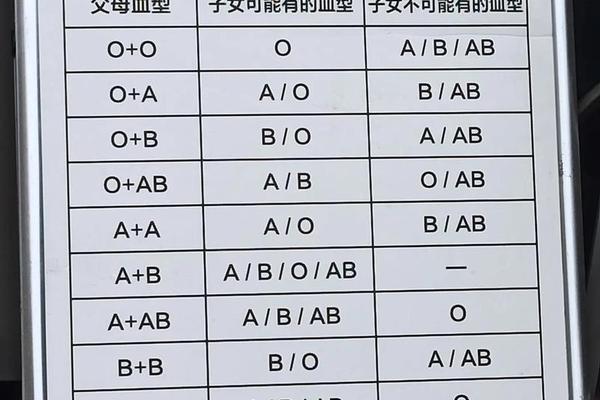
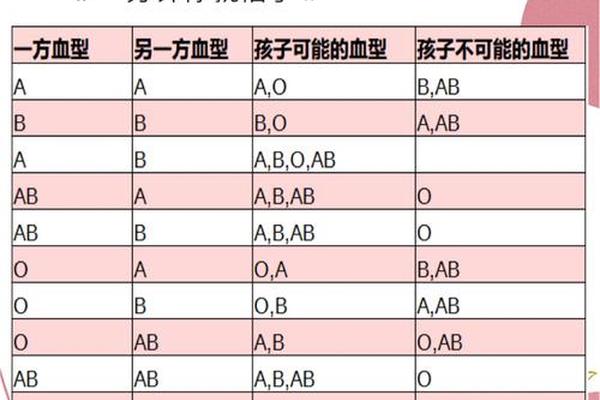
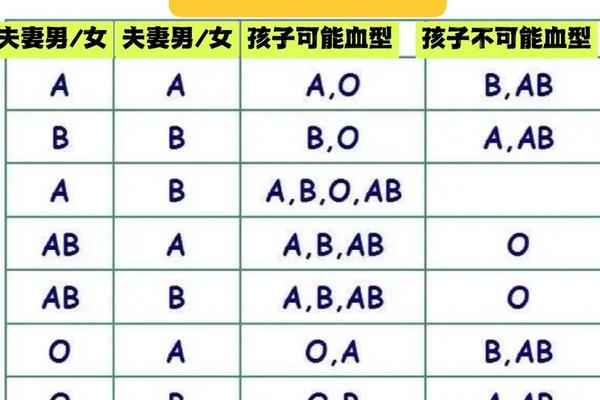
类A物质的形成与Hh血型系统密切相关。孟买血型(hh基因型)个体因完全缺失H抗原前体,即使携带IA或IB基因也无法合成A/B抗原,其红细胞表面仅能检测到微量类A物质。此类案例曾引发亲子鉴定争议:当父母一方为AB型时,传统遗传规律预测后代不可能出现O型,但孟买血型个体因抗原缺失可能被误判为O型,直至特异性抗H血清检测揭示真相。
在病理条件下,基因表达调控异常是类A物质产生的重要诱因。白血病细胞中常见的染色体易位(如t(9;22))可能破坏9号染色体上的ABO基因簇,导致糖基转移酶合成障碍。肿瘤微环境中的炎症因子(如TNF-α)可诱导糖基化修饰异常,促进类A物质生成。这种获得性血型变异具有可逆性,在疾病缓解期可能恢复原有抗原表达。
四、临床输血安全的应对策略
针对类A物质引发的输血风险,现行指南提出分级管理方案:对于抗原表达减弱患者,推荐输注经γ射线辐照的洗涤红细胞,并严格进行交叉配血试验;对于造血干细胞移植后血型转换期患者,需建立动态监测体系,每两周进行血型复检直至完全转换。值得注意的是,O型血浆并非绝对安全,其含有的抗A/B抗体可能攻击受体残存的类A物质,引发迟发性溶血反应。
技术创新为这类问题提供新思路。丹麦技术大学团队发现嗜黏蛋白阿克曼菌分泌的酶系可高效清除红细胞表面异常抗原,将类A物质阳性血液转化为通用O型。单克隆抗体技术的发展使得针对类A物质表位的特异性检测试剂盒逐步进入临床验证阶段,有望实现0.1%抗原表达量的精准识别。

五、未来研究方向与转化医学价值
当前研究亟待突破三大瓶颈:其一,建立类A物质的定量检测标准,通过流式细胞术测定抗原分子密度,取代传统的半定量凝集强度分级;其二,探索CRISPR-Cas9基因编辑技术在纠正Hh基因突变中的应用潜力;其三,开发人工智能辅助诊断系统,整合患者临床数据与实验室指标,实现血型异常风险的早期预警。
从公共卫生视角看,建立区域性稀有血型数据库至关重要。日本红十会通过全民血型分子筛查,已识别出217例类A物质相关变异型,并建立定向献血者档案。这种精准管理模式可将输血不良反应率降低63%。随着个体化医疗发展,针对类A物质的血型适配策略将从被动应对转向主动预防,重塑现代输血医学范式。
总结
类A血型物质的存在揭示了ABO血型系统的复杂性与动态性,其形成机制涉及遗传、病理、代谢等多维度因素。临床实践中需摒弃“血型终身不变”的固有认知,通过多技术联用提升检测精度。未来研究应聚焦分子诊断技术革新与跨学科协同,最终构建兼顾安全性与可及性的智能输血体系。建议医疗机构将血型动态监测纳入肿瘤、血液病患者的常规随访项目,并为抗原变异高风险群体建立专属血库,切实保障特殊人群用血安全。