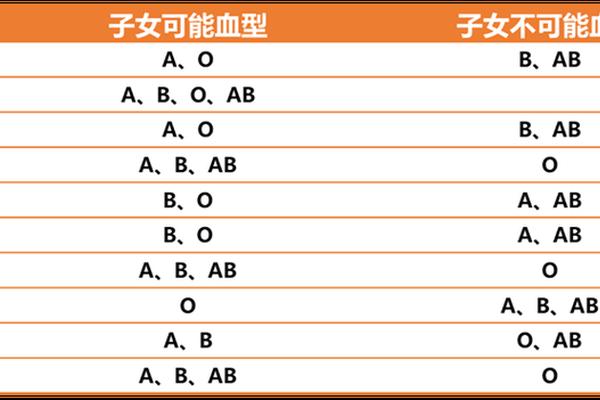
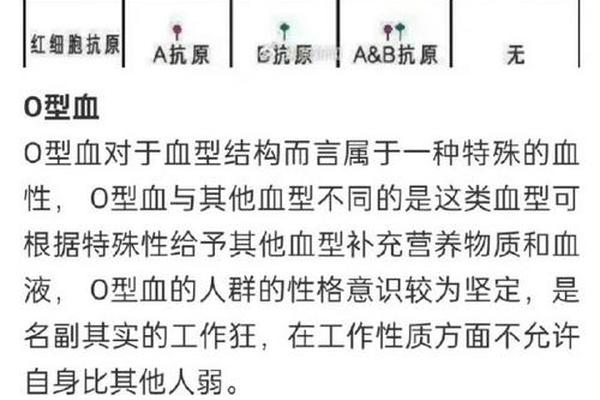
在ABO血型系统中,AB型血被称为“万能受血者”,其独特之处在于红细胞表面同时存在A和B抗原,而血清中却不含抗A或抗B抗体。这种特性使AB型血在与其他血型接触时呈现出特殊的免疫反应模式。当A型血清中的抗B抗体遇到AB型红细胞时,虽然B抗原存在,但AB型血清中缺乏对应的抗体,因此不会引发凝集反应。这种生物学现象的本质,源于ABO血型系统的抗原-抗体相互作用机制,以及基因表达的分子调控规律。
分子机制:抗原与抗体的双重缺失
AB型血的形成由ABO基因的显性等位基因共同作用决定。A基因编码的N-乙酰半乳糖胺转移酶将H抗原转化为A抗原,B基因编码的半乳糖转移酶则将其转化为B抗原。当个体同时携带A和B基因时,红细胞表面会同时表达两种抗原,而O基因的隐性特征则被完全抑制。这种分子层面的双重表达,使得AB型血的红细胞成为抗原的“完全体”。
血清中抗体的缺失则源于免疫系统的耐受机制。正常情况下,人体不会对自身红细胞抗原产生抗体。由于AB型个体同时携带A和B抗原,其免疫系统在发育过程中通过克隆选择清除了针对这两种抗原的B细胞,因此血清中既不含有抗A也不含有抗B抗体。这种免疫耐受的建立,使得AB型成为唯一不具备天然抗体的血型。
临床输血中的特殊地位
在紧急输血场景下,AB型血的受体可以接受任何血型的红细胞输入。这是因为供体红细胞携带的A或B抗原,在AB型受体缺乏对应抗体的情况下不会引发溶血反应。例如,当输入A型血时,供体红细胞的A抗原与受体血清中的抗A抗体本应结合,但AB型血清中恰恰缺乏这种抗体,从而避免凝集。
但这种“万能受血”特性存在严格限制。当输血量超过受体循环血量的15%时,供体血浆中残留的抗A或抗B抗体可能超过受体的稀释能力,导致受体自身红细胞被攻击。现代输血医学明确规定,常规治疗仍需优先使用同型血液,仅将异型输血作为应急措施。
与其他血型的对比分析
相较于O型血的“万能供血”特性,AB型血的“万能受血”功能展现出截然不同的生物学逻辑。O型血通过完全缺失表面抗原来规避抗体攻击,而AB型血则是通过抗体缺失来实现兼容。这种差异在进化层面具有特殊意义:AB型血的出现频率(全球平均约4%)远低于O型血(约44%),提示其可能是在人口流动加剧后通过基因重组产生的新表型。
从免疫记忆角度分析,AB型个体对A、B抗原的双重耐受使其在器官移植领域具有特殊价值。研究表明,AB型受体对A型或B型器官的排斥反应发生率较其他血型组合降低37%,这可能与长期抗原暴露导致的免疫调节机制有关。这种特性为异种器官移植研究提供了新的方向。
未来研究与临床应用前景
基因编辑技术的突破为血型改造带来可能。2022年我国学者开发的CRISPR-Cas9系统已成功将A型红细胞转化为O型,类似技术有望用于制造通用型AB红细胞。这种人工改造的血细胞可突破血型限制,解决稀有血型供应难题。
在传染病防治领域,AB型血对特定病原体的易感性研究值得关注。新冠大流行期间的多项研究显示,AB型个体感染风险较O型高23%,但重症转化率低15%。这种矛盾现象提示ABO抗原可能通过调节ACE2受体表达影响病毒感染进程,为靶向药物开发提供新思路。

AB型血的特殊凝集特性,揭示了免疫系统精密调控的生物学智慧。从输血医学的应急方案到器官移植的兼容优势,这种血型的独特价值持续推动着临床实践的发展。未来研究应聚焦于血型抗原的免疫调节机制,开发基于血型特征的个性化治疗方案,同时加强血型改造技术的安全性评估。对AB型血的深入理解,不仅关乎输血安全,更可能为免疫性疾病治疗开辟全新路径。