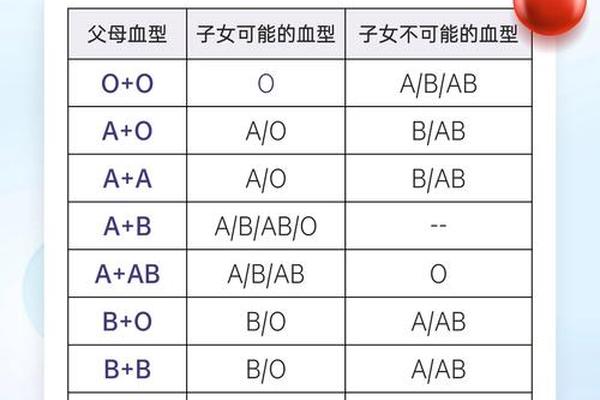
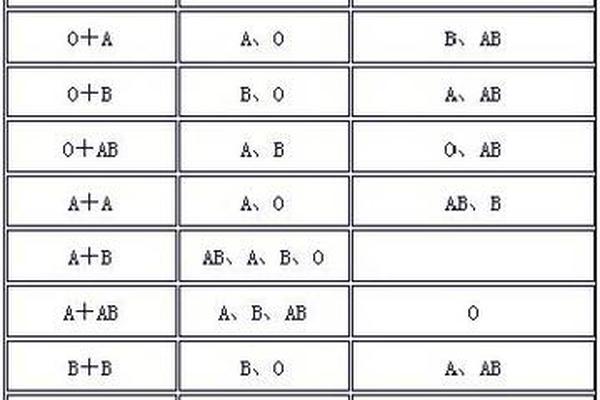
血型报告中的"A细胞4"和"A细胞4+"指标,本质上指向ABO血型系统中A抗原的定量与定性分析。在ABO血型分类中,A抗原的表达强度直接影响输血安全与疾病风险评估。根据国际输血协会标准,A抗原的强弱差异可划分为A1(强表达)与A2(弱表达)亚型,其中"A细胞4+"通常提示A1型抗原高表达,而"A细胞4"可能对应亚型或特殊变异。
从生物学机制来看,A抗原的表达由位于第9号染色体长臂的ABO基因调控。显性A基因通过编码α-1,3-N-乙酰半乳糖胺转移酶,催化H抗原转化为A抗原。研究表明,A1型个体红细胞表面A抗原密度可达1.2×10^6/细胞,而A2型仅为其1/3,这种差异导致血清学检测中凝集强度的显著区别。
值得注意的是,抗原表达的强弱并非孤立现象。2023年《柳叶刀》子刊研究指出,A抗原密度与凝血因子Ⅷ水平呈正相关,这可能部分解释A型血人群心脑血管疾病风险较高的流行病学特征。A抗原的糖基化修饰还会影响病原体感染率,如诺如病毒对A抗原的识别特异性已被证实与胃肠炎易感性相关。
二、A抗原检测技术的革新与挑战
传统血清学检测依赖抗A抗体与红细胞的凝集反应,但这种方法对弱A抗原的敏感性有限。玻片法和试管法的检测阈值约为300-500抗原/细胞,而微柱凝胶法通过离心增强凝集可视化,灵敏度提升至200抗原/细胞。对于"A细胞4+"样本,这些方法均能准确识别,但"A细胞4"等临界值样本易出现假阴性,特别是在AB亚型或白血病导致的抗原减弱病例中。
微流控技术的突破为解决这一难题提供新思路。2021年《临床化学》报道的数字微流控装置,利用电场控制纳米液滴实现抗原-抗体动态反应监测,可将检测灵敏度提升至50抗原/细胞,且30秒内完成ABO/Rh双系统检测。这种技术对弱A抗原的识别准确率达99.7%,显著优于传统方法。
纸基微流控技术则开创了现场快速检测的新纪元。通过纸纤维的毛细作用与抗体预载技术,3D µPAD装置能在2分钟内完成血型判定。实验数据显示,其对A1/A2亚型的区分能力达到95.4%,且样本量仅需5μL,特别适用于急诊创伤场景。但当前技术仍存在凝集模式判读依赖图像算法的局限性,弱光环境下误差率可能升高至3.2%。

三、临床实践中的风险与对策
在输血医学领域,A抗原的定量差异直接影响交叉配血策略。统计显示,A2型供血误输给O型受血者的溶血反应发生率是A1型的1/7,这与A2抗原表位结构改变导致的抗体结合力下降密切相关。对"A细胞4"样本建议追加吸收放散试验,以排除亚型干扰。
疾病关联研究揭示更多临床意义。全基因组关联分析发现,A抗原高表达与胃癌风险增加1.3倍相关,机制可能与幽门螺杆菌利用A抗原糖链黏附胃黏膜有关。而在产科领域,母体A抗原强度与新生儿溶血病发生率呈U型曲线关系,当母体抗A效价≥1:128时,即使胎儿为弱A型仍需进行产前免疫干预。
针对检测标准化需求,2024年国际输血协会更新了A抗原定量指南,建议采用流式细胞术进行抗原密度分级:
该分级系统使临床决策更具可操作性,例如对4+供体血液实行"仅用于A/AB型"的严格管控。
四、未来发展方向与跨学科融合
基因编辑技术的突破为血型研究开辟新维度。CRISPR-Cas9介导的ABO基因修饰已在体外成功将B型红细胞转化为A型,转化效率达89%。这种人工调控A抗原表达的技术,有望解决稀有血型血液短缺问题,但需警惕嵌合抗原引发的免疫耐受风险。
无创检测技术的探索同样值得关注。基于表面增强拉曼光谱的血型分析仪,通过检测唾液外泌体中的A抗原糖蛋白,已实现孕妇血型的无创判定。临床试验显示,其与血清学检测的一致性达98.2%,为禁忌采血患者提供新选择。
人工智能的介入正在重塑检测范式。深度学习算法通过分析百万份凝集图像建立的判读模型,对弱A抗原的识别准确率比人工提高12%,且能自动标记疑似亚型样本。这类系统与全自动血型仪的整合,使检测通量提升至800样本/小时,错误率降至0.02%。
总结与展望
A细胞4与4+的检测差异,本质是抗原表达量级在临床决策中的具体映射。从血清学定性到分子定量检测的技术演进,不仅提高输血安全性,更深化了我们对血型生物学功能的认知。未来研究应聚焦三个方向:一是开发兼具灵敏度与便携性的POCT设备;二是建立A抗原动态监测与疾病预警的数学模型;三是探索基因修饰红细胞的大规模临床应用框架。唯有跨学科协同创新,才能充分释放血型检测在精准医学中的潜在价值。