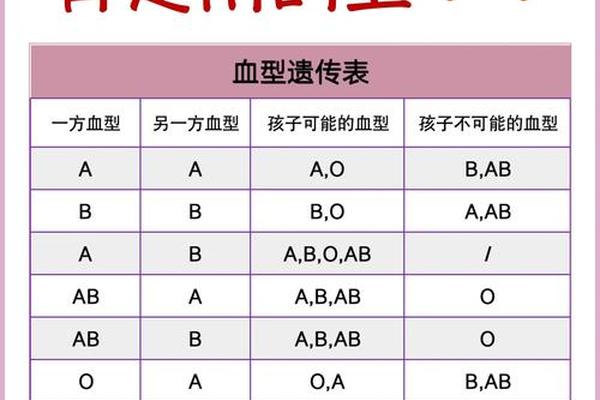
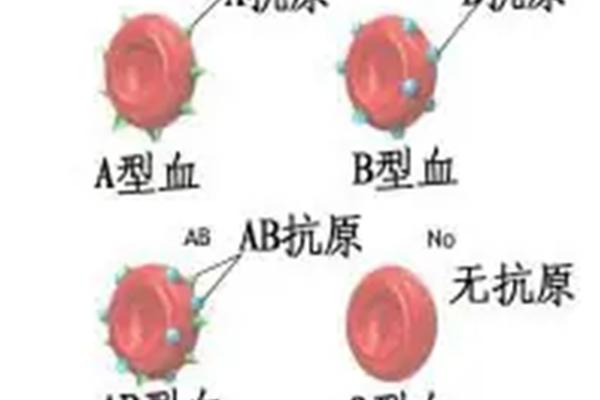
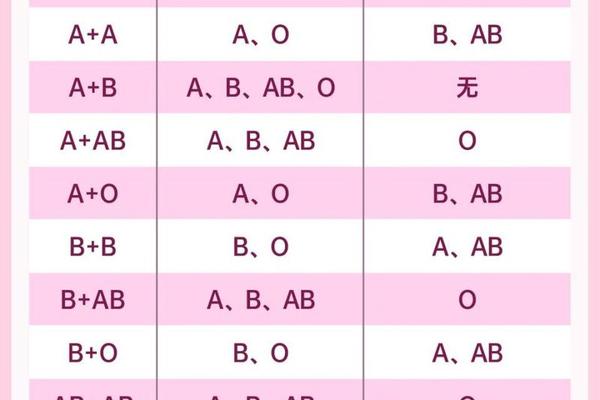
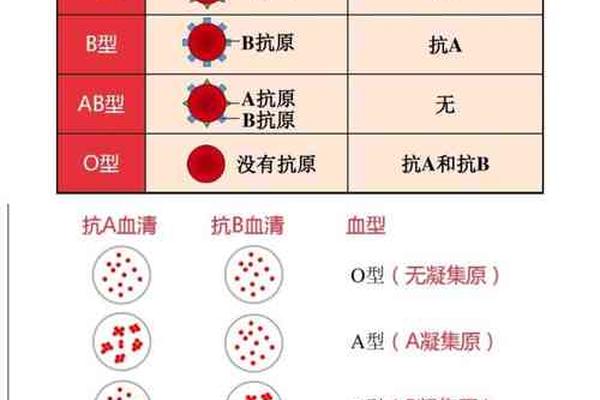
血型系统的核心在于红细胞表面抗原的差异,ABO血型分类基于A、B抗原的分布。AB型血的红细胞同时携带A和B抗原,而血清中不含抗A或抗B抗体。当AB型血转变为A型或AB+型时,本质上是抗原表达的动态变化。例如,AB型血在特定条件下丢失B抗原,仅保留A抗原,则被检测为A型;而AB+中的“+”通常指RhD抗原阳性,属于Rh血型系统的分类。
这种改变可能源于基因层面的永久性替换或抗原表达的暂时性抑制。例如,造血干细胞移植后,供体的细胞完全替代受体自身的造血系统,导致红细胞抗原类型与供体一致。研究显示,接受ABO血型不合的移植患者,术后血型会逐步转变为供体型,这一过程涉及原有红细胞的衰亡与新红细胞的生成。某些肠道细菌(如嗜黏蛋白阿克曼菌)产生的酶能特异性切割A或B抗原的糖链结构,通过生物工程技术可将AB型红细胞转化为A型或O型。
二、医学干预下的血型改变
在临床治疗中,血型改变主要分为两种类型。永久性改变常见于造血干细胞移植,例如白血病患者接受A型供体的后,其血型会逐渐从AB型转为A型。这一过程需要数月时间,期间可能出现混合血型状态(既有AB型残留红细胞,又有新生成的A型红细胞),输血需严格遵循供体型血制品。暂时性改变则与疾病或治疗手段相关,如化疗药物可能破坏红细胞膜上的抗原结构,导致AB型被误检为A型;肠道感染中的细菌酶也可能短暂清除B抗原,使AB型呈现A型特征。
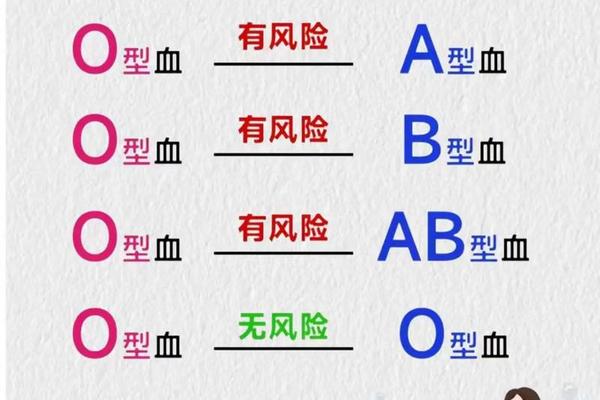
值得注意的是,Rh血型系统独立于ABO系统。AB+型指AB型且RhD抗原阳性,我国约99%人群为Rh阳性。Rh血型转换极为罕见,目前仅见于器官移植领域的研究突破。例如,加拿大团队通过离体肺灌注系统清除器官血管中的A抗原,成功将AB型供肺转换为“通用型”,但受体自身的Rh血型不受影响。此类技术未来可能推动AB+型器官的跨血型移植应用。
三、技术驱动的血型改造
近年来,酶工程技术为人工改造血型开辟了新路径。丹麦科学家从肠道菌群中分离出Flavonifractor plautii菌株,其分泌的两种酶能精准去除A抗原中的N-乙酰半乳糖胺,将AB型红细胞转化为B型;若同时使用其他酶系,甚至可进一步转化为O型。这种“分子手术刀”技术已在小鼠模型中验证安全性,处理后的红细胞存活率与天然血型无显著差异。
另一项突破来自器官移植领域。多伦多大学团队利用体外肺灌注系统,向AB型供肺注入特定酶溶液,成功清除血管内皮细胞的B抗原,使其可安全接受O型受体的血液灌注。这种局部血型转换技术避免了全身性免疫排斥,为AB+型器官的跨血型利用提供可能。当前技术仍局限于特定组织,全身血型转换仍需攻克抗体清除、微环境重构等难题。
四、与临床应用挑战
血型转换技术虽前景广阔,但面临多重挑战。生物学层面,抗原清除的彻底性存疑:残留的微量B抗原仍可能引发免疫反应。研究显示,酶处理后的A型红细胞仍有约5%的抗原残留,需结合抗体吸附技术才能确保输血安全。学层面,人为改变血型可能引发身份认知危机,尤其在涉及基因编辑的案例中。日本学者曾提出,血型文化根深蒂固的社会需审慎对待此类技术。
临床应用需建立新的检测标准。传统血型鉴定依赖抗原-抗体凝集反应,而改造后的红细胞可能呈现“表型-基因型不符”。例如,AB型经酶处理转为A型后,基因检测仍显示AB型特征,这可能干扰亲子鉴定、法医学调查等。国际输血协会建议对改造血制品进行双重验证:既检测抗原表达,又分析基因型。
总结与未来展望
血型从AB转变为A或AB+,既是生物学现象的突破,也是医学技术进步的表征。这种改变可通过干细胞移植实现永久转换,或借助酶工程达成暂时调整,其核心在于精准调控抗原表达。当前研究已证明,血型转换能缓解器官移植供体短缺、提升输血安全性,但技术成熟度、兼容性仍需完善。
未来研究方向应聚焦于三个维度:其一,开发更高效的抗原清除酶,例如通过定向进化技术优化酶活性;其二,探索血型转换与免疫耐受的协同机制,减少抗体依赖性排斥;其三,建立全球血型数据库,动态追踪改造血制品的长期影响。唯有攻克这些难关,才能让血型转换技术真正服务于人类健康,而非止步于实验室的奇迹。