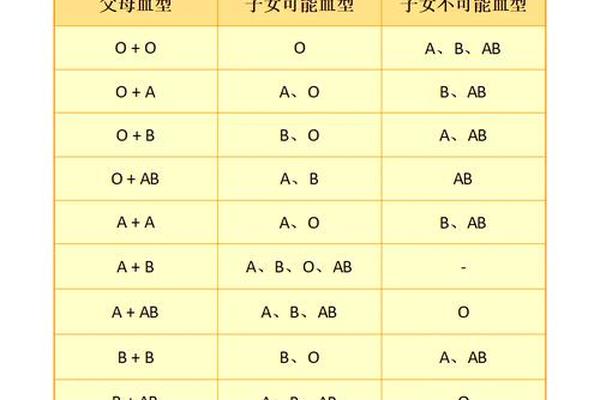
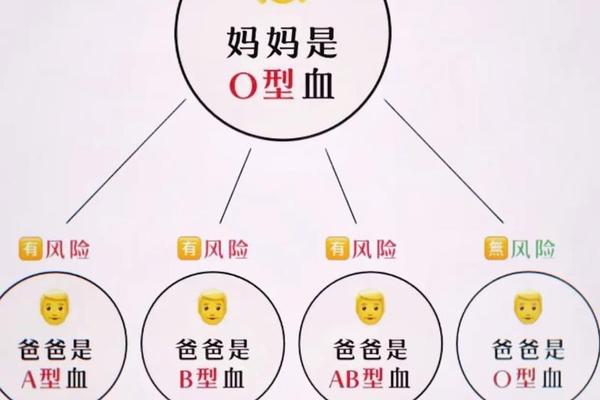
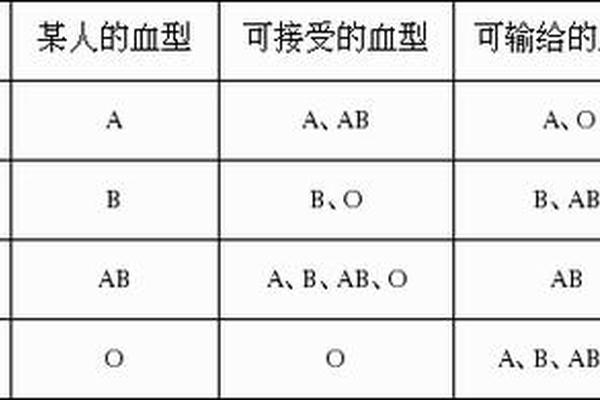
人类对血型与疾病关系的探索已持续百年,其中A型血与癌症的关联性备受关注。多项大规模流行病学研究发现,携带A抗原的A型或AB型血人群的癌症发病率显著高于非A型血群体,而O型血则表现出相对较低的风险。例如,上海交通大学对1.8万名志愿者的追踪研究显示,A型血人群的胃癌和结直肠癌发病率比O型血高18%-23%。这种差异可能与A抗原对炎症反应和细胞增殖的调控作用相关。
从生物学机制看,A型血人群的红细胞表面抗原结构可能影响病原体感染概率。研究发现,A型血个体更容易感染幽门螺杆菌,而长期感染是胃癌的重要诱因。A抗原与某些肿瘤标志物的相似性可能导致免疫系统识别障碍,使癌细胞逃脱监控。例如,膀胱癌患者中A型血的复发率高达50%-70%,显著高于其他血型。
尽管存在统计学关联,学术界仍强调血型并非决定性因素。2011年《国际癌症杂志》指出,A型血与卵巢癌风险的相关性可能受遗传背景干扰。而2021年瑞典研究甚至质疑血型与癌症的直接联系,认为环境因素占比更大。这些矛盾结论提示,A型血的癌症易感性需结合基因多态性和表观遗传学进一步验证。
二、消化系统疾病的显著倾向
A型血人群在消化系统疾病中表现出明确的易感性。1953年英国首次发现A型血与胃癌的强相关性,后续研究证实其胃癌发病风险比O型血高18%。这可能与A抗原促进胃黏膜细胞异常增殖有关。日本学者提出,A型血个体的胃酸分泌模式更易造成黏膜损伤,从而诱发慢性炎症。
肠道菌群研究为这一现象提供了新视角。2020年《自然》期刊指出,A型血人群的肠道菌群中促炎菌属比例偏高,可能通过激活NF-κB通路加剧肠道炎症。癌风险分析显示,A型血患者血清中的CA19-9(一种黏蛋白类肿瘤标志物)水平异常升高,提示A抗原可能参与导管细胞的恶性转化。
三、心血管疾病的潜在威胁
在心血管领域,A型血的风险特征同样显著。2022年《Neurology》发布的涵盖60万人的研究显示,A型血人群在60岁前发生缺血性中风的概率比其他血型高16%。机制研究表明,A型血个体的血管性血友病因子(vWF)浓度较高,可能促进血小板聚集和血栓形成。
冠心病(CAD)的关联性研究更引发关注。Meta分析显示,A型血人群的低密度脂蛋白胆固醇(LDL-C)水平比O型血高9.3mg/dL,冠状动脉钙化积分增加17%。这种现象可能与ABO基因对脂质代谢酶的调控有关。但需注意,这些差异在健康生活方式干预下可显著缩小,提示后天因素的关键作用。

四、多维防控策略的构建
针对A型血的疾病倾向,预防医学领域提出分级干预方案。对于癌症高风险群体,建议将胃镜筛查年龄提前至35岁,并每3年进行幽门螺杆菌检测。在心血管防护方面,美国心脏协会推荐A型血人群将LDL-C控制目标设定为<70mg/dL,较通用标准更为严格。
生活方式调整的重要性在多项研究中被反复强调。日本国立癌症研究中心发现,A型血吸烟者的肺癌风险比非吸烟者高3.2倍,但5年后该差异消失。营养学干预方面,富含Omega-3脂肪酸的饮食可显著降低A型血人群的炎症标志物水平,建议每周摄入深海鱼类至少2次。
现有证据表明,A型血与特定疾病的相关性更多体现为风险提示而非命运定论。从公共卫生角度看,将血型纳入个性化医疗评估体系,有助于实现精准预防。例如,对A型血人群实施胃癌早期筛查可节省23%的医疗资源。未来研究需着重破解ABO基因与疾病通路的分子机制,同时开展跨种族、多中心的长期队列研究以消除混杂因素干扰。
值得关注的是,表观遗传学的最新进展为风险调控提供了新思路。2024年《细胞》期刊报道,DNA甲基化修饰可部分逆转A型血的炎症倾向。这提示,即使存在遗传易感性,通过表观干预仍可能重塑疾病轨迹。在个体层面,建立涵盖血型特征的健康管理档案,结合基因组学和代谢组学数据,将推动预防医学进入全新维度。