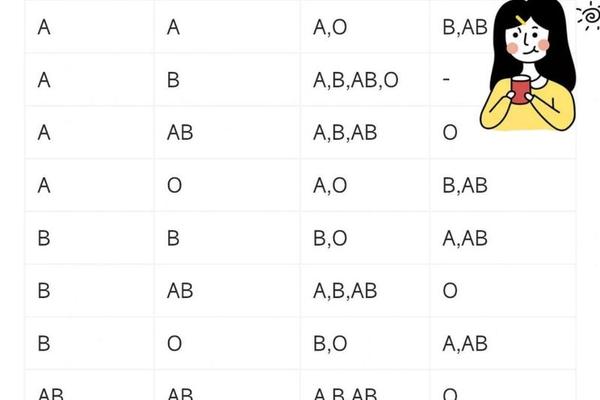
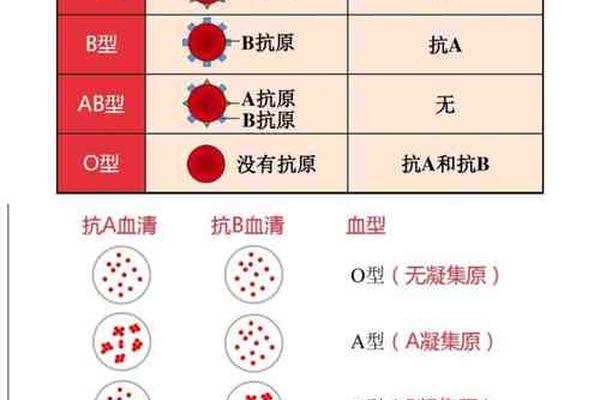
人类ABO血型系统的形成依赖于基因调控的红细胞表面抗原表达。A型血个体的红细胞携带A抗原,这是由位于9号染色体上的ABO基因位点决定的显性遗传特征。当个体从父母处遗传到至少一个A型等位基因时,其体内β-1,3-N-乙酰半乳糖胺转移酶会催化H抗原末端添加N-乙酰半乳糖胺,形成具有独特空间构象的A型糖链结构。这种抗原不仅是免疫识别的基础,更通过跨膜蛋白与细胞骨架相连,构成红细胞表面稳定的分子标记。
Rh血型系统的D抗原则为A+血型提供了第二个关键维度。位于1号染色体的RHD基因编码的D抗原属于跨膜蛋白家族,其复杂的三维结构在红细胞表面形成免疫原性位点。约85%的亚洲人群携带Rh阳性特征,这意味着他们的红细胞膜上存在完整的D抗原表达。当A型与Rh阳性叠加时,血液系统将产生抗B抗体但不含抗D抗体,这种特异性免疫应答机制直接决定了输血相容性边界。
临床医学中的双重身份验证
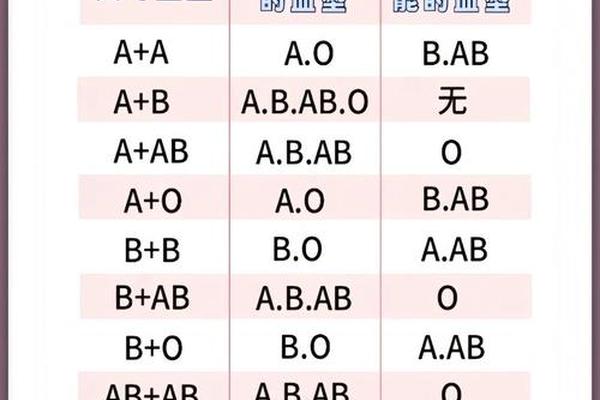
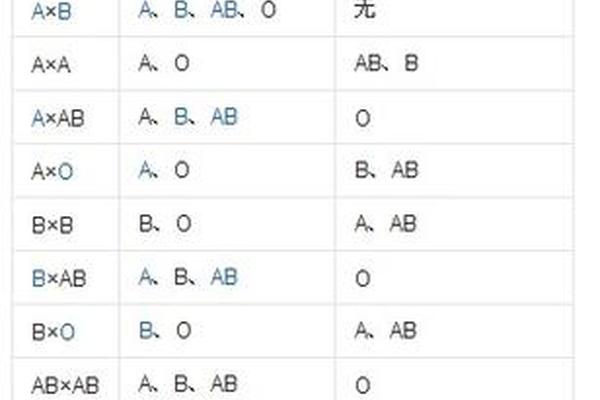
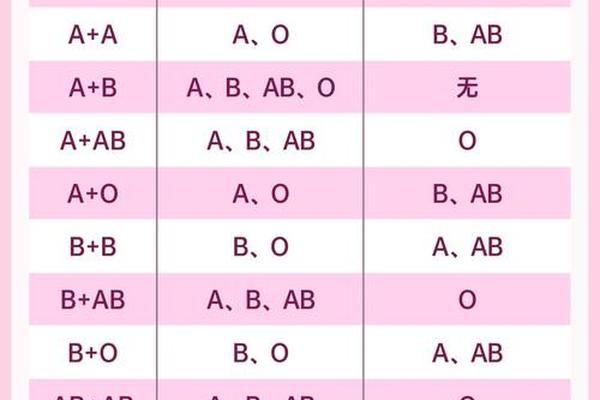
在输血医学领域,A+血型展现出独特的双刃剑特性。作为ABO系统中的抗原携带者,其血浆内天然存在的抗B抗体,使得该血型可安全输注给同型或AB+型受血者,但必须严格避免输注至B型或O型个体。Rh阳性特征进一步限定了输血场景——虽然A+血型可接受A+/A-血液,但Rh阴性患者若输入A+血液,可能因D抗原触发免疫记忆反应,导致未来妊娠或再次输血时发生严重溶血。
母婴血型不合的潜在风险在产科领域尤为突出。当A+血型孕妇为Rh阴性时,胎儿若遗传父源Rh阳性基因,母体免疫系统可能产生抗D抗体,引发新生儿溶血病。现代产前筛查通过抗球蛋白试验和抗体效价监测,已能将此类风险控制在0.5%以下。值得注意的是,即便在ABO系统内,约15%的O型血母亲怀有A型胎儿时,仍可能发生轻度溶血性黄疸,这揭示了血型系统相互作用的复杂性。
分子人类学视角下的进化轨迹
从人类迁徙史观察,A型血基因频率呈现显著地理梯度差异。欧洲人群中A型占比达40%,而在东亚地区该比例降至27%。分子钟分析显示,ABO基因多态性可能起源于30万年前,与智人走出非洲的迁徙浪潮同步。有趣的是,A型等位基因在农业文明发源地的富集现象(如美索不达米亚流域达38%),提示其可能与谷物驯化过程中的病原体选择压力相关。但这一假说仍需通过古DNA分析和病原体共进化模型验证。
Rh血型系统的进化路径则更为扑朔迷离。尽管D抗原缺失会导致Rh阴性表型,但在自然界中黑猩猩等灵长类却普遍缺乏该特征。分子生物学研究发现,RHD基因在人类进化过程中发生过多次重复与缺失事件,这可能与古代流行病(如疟疾)的选择压力相关。最新全基因组关联研究表明,Rh阳性个体对某些革兰氏阴性菌感染具有更强抵抗力,这或许解释了其在热带地区的适应性优势。
未来研究与精准医疗的交汇点
随着单细胞测序技术的突破,科学家开始揭示血型抗原表达的异质性。2024年NTU研究团队发现,XG血型系统与CD99抗原的共表达机制受GATA1转录因子调控,这为理解血型系统间的网络化调控提供了新视角。在P1/PK系统研究中,EGR1转录因子被证实通过结合A4GALT基因内含子区域SNP,精细调节α4GalT酶活性,这提示血型抗原表达可能具有环境响应性。这些发现为开发体外人工造血系统提供了分子调控靶点。
在临床转化层面,基于CRISPR的血型编辑技术正从实验室走向应用。2023年《自然·医学》报道了首例通过基因编辑将A型造血干细胞转化为O型的临床试验,成功解决了稀有血型患者的移植难题。而合成生物学团队则尝试在工程化红细胞表面表达通用型抗原,这种“去免疫原性”设计可能彻底改写输血医学规则。但学家警告,血型作为生物特征标记的社会学意义需要审慎评估,特别是在基因隐私和身份识别领域。
生命密码的现代诠释
从卡尔·兰德斯泰纳1900年的凝集实验到今天的表观遗传学研究,人类对A+血型的认知已跨越分子生物学、临床医学和人类进化的多维空间。这种红色液体中蕴含的抗原密码,不仅是免疫防御的第一道屏障,更是人类适应环境变迁的进化见证。当前研究揭示,血型系统远非静态的遗传标记,而是动态的生物学网络,与病原体防御、器官移植耐受乃至肿瘤免疫微环境密切关联。
展望未来,血型研究需突破传统血清学框架,在系统生物学层面整合多组学数据。特别需要关注血型抗原在非红细胞组织(如血管内皮和神经细胞)中的异位表达现象,以及其与自身免疫疾病的潜在联系。正如诺贝尔奖得主彼得·梅达沃所言:“血液中的每个分子都在讲述生命的故事”,解码A+血型的奥秘,终将引领我们更深刻地理解生命的适应与演化之道。