在人类血型系统中,O型与A型血型间的相互作用始终是医学界关注的焦点。当O型血母亲孕育A型血胎儿时,两种血型的抗原差异可能引发免疫反应,导致新生儿ABO溶血病。这种现象源于母体血液中的抗A抗体通过胎盘进入胎儿循环系统,攻击胎儿的红细胞,造成溶血性贫血、黄疸等严重后果。据统计,我国约20%-30%的母婴血型不合案例属于此类,其临床表现虽以轻症为主,但仍有部分病例可能危及生命。本文将深入探讨O型与A型血型溶血的生物学机制、临床管理策略及预防措施。
一、ABO溶血病的生物学基础
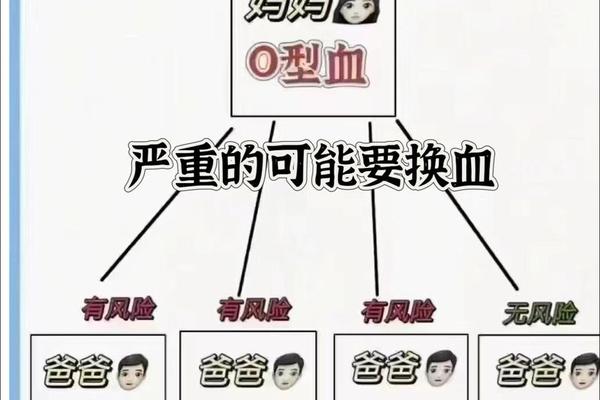
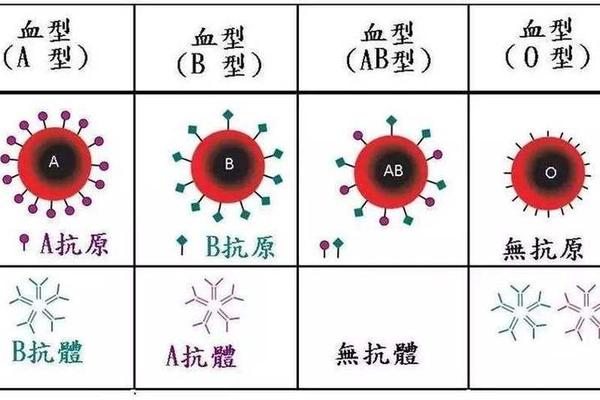
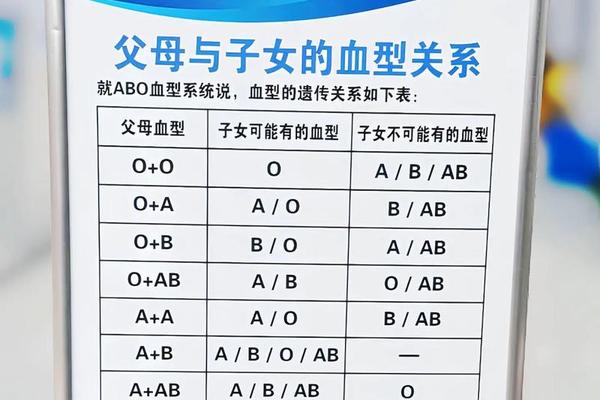
ABO血型系统的抗原差异是溶血发生的核心机制。O型个体红细胞表面缺乏A、B抗原,但其血清中含有天然的抗A、抗B抗体(IgG型)。当O型母亲孕育A型胎儿时,胎儿的A型红细胞抗原通过胎盘进入母体循环,刺激母体产生高浓度抗A抗体。这些抗体再经胎盘返回胎儿体内,与胎儿红细胞的A抗原结合,形成抗原-抗体复合物,引发补体介导的红细胞溶解。
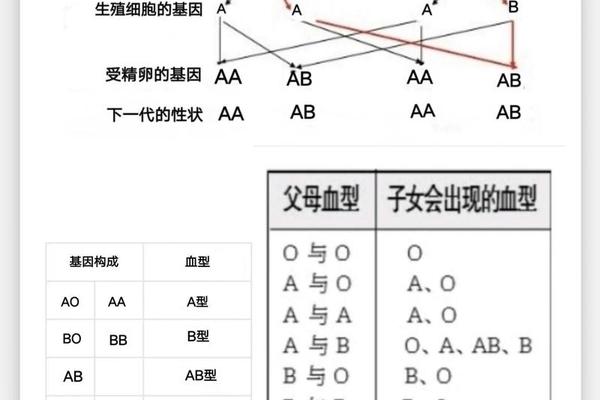
从遗传学角度分析,ABO基因位于人类第9号染色体长臂,其等位基因决定了红细胞表面糖基转移酶的活性。A型基因编码的N-乙酰半乳糖胺转移酶催化H抗原转化为A抗原,而O型基因因碱基缺失导致酶活性丧失,保留原始H抗原结构。这种分子层面的差异,使得母胎间的免疫识别系统将对方红细胞视为异物进行攻击。
二、临床特征与诊断路径
新生儿ABO溶血病主要表现为进行性加重的黄疸,约25%病例在出生24小时内出现皮肤黄染,血清总胆红素水平常超过342μmol/L。实验室检查可见网织红细胞计数异常增高(>6%),外周血涂片出现球形红细胞,直接抗人球蛋白试验(DAT)阳性率达90%以上。值得注意的是,约5%患儿会发展为重度贫血(血红蛋白<60g/L),伴有肝脾肿大及核黄疸风险,后者可导致不可逆的神经损伤。
产前诊断体系包含抗体效价动态监测与影像学评估。妊娠16周起,通过微柱凝胶法检测母体IgG抗A效价,当效价≥1:128时提示高风险。超声检查若发现胎儿皮肤水肿(>5mm)、肝脾肿大(肝长度/腹围比>0.55)或胎盘增厚(>4cm),需警惕严重溶血可能。南京溧水区人民医院的研究显示,孕晚期抗体效价≥1:512时,新生儿溶血发生率可达34.7%,且与高胆红素血症呈正相关(OR=4.521)。
三、治疗策略与预防进展
光照疗法作为一线治疗手段,通过波长425-475nm的蓝光促使脂溶性胆红素转化为水溶性异构体。临床数据显示,连续48小时光照可使血清胆红素日均下降17.1-34.2μmol/L,有效预防核黄疸发生。对于重症病例(胆红素>428μmol/L),换血治疗可将致敏红细胞清除率提升至85%,采用O型红细胞与AB型血浆的混合置换液,能同时纠正贫血和抗体负荷。
预防体系构建需贯穿孕前至产后阶段。建议O型血女性孕前检测配偶ABO血型,若存在不合风险,孕16周起每月监测抗体效价。Rh阴性孕妇在妊娠28周及产后72小时内注射300μg抗D免疫球蛋白,可使Rh溶血发生率从16%降至0.1%。新兴的生物制剂如单克隆抗体FC工程化改造技术,正在临床试验中展现阻断母体IgG抗体经胎盘转运的潜力。
四、社会认知与风险管理
尽管ABO溶血病认知度逐年提高,但调查显示仅38.2%的O型血孕妇主动进行产前抗体筛查。这与社会对轻型病例的忽视有关——约60%的ABO溶血患儿仅表现为轻度黄疸,但其中15%会发展为慢性溶血性贫血。商业保险产品的介入提供了新的风险管理思路,如"水滴接好孕"等孕期专属保险,覆盖了蓝光治疗、换血手术等费用,其报销比例可达医疗支出的70%-90%。
未来研究应聚焦于精准预测模型的建立。通过整合母体HPA-1/5基因多态性、胎儿Kell抗原表达等参数,有望将风险预测准确率从现有的78.3%提升至95%以上。基因编辑技术的突破也为根治带来曙光,2023年《自然》杂志报道的CRISPR-Cas9介导的ABO基因座修饰,已在灵长类模型中成功实现血型抗原的定向改造。
O型与A型血型间的溶血风险,本质上是人类进化过程中形成的免疫防御机制在特定条件下的异常激活。通过多学科协作建立的"监测-干预-保障"三级防控体系,已使重症溶血病的发生率下降至0.7‰。随着分子诊断技术的进步和社会支持体系的完善,我们有理由相信,血型不合带来的健康威胁将得到更有效的控制。