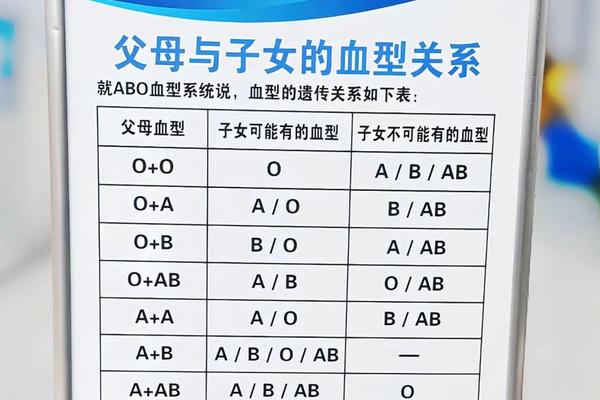
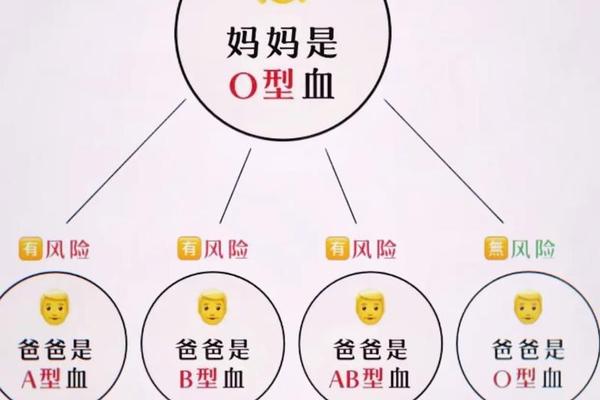
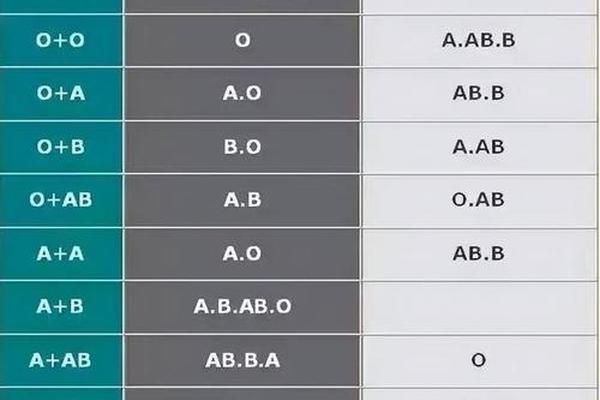
人类ABO血型系统由红细胞表面特异性抗原决定,A型血携带A抗原,B型血携带B抗原,AB型兼具两者,O型则无。从遗传学角度看,血型由9号染色体上的ABO基因决定,具有高度稳定性。但近年临床观察发现,A型血向AB或B型转变的现象可能由抗原表达异常引起:A抗原的分子结构为H抗原末端连接N-乙酰半乳糖胺,若该基团被细菌酶切断或修饰,可能转化为类似B抗原的半乳糖结构,导致血型检测结果改变。
这一过程的核心在于抗原的"信号强弱"。正常情况下,基因调控的抗原表达稳定,但在疾病、感染或医疗干预下,抗原信号可能被削弱或转化。例如肠道感染中,厌氧菌Flavonifractor plautii产生的脱乙酰酶能切断A抗原的氨基半乳糖,使其转变为B抗原的类似结构,此时A型血可能暂时表现为AB型或B型。这种分子层面的动态调整,为血型转变提供了科学依据。
二、疾病与医疗干预的催化作用
血液系统疾病是血型改变的重要诱因。白血病患者的造血干细胞发生恶性变异,可能干扰ABO基因表达,导致红细胞膜上A抗原数量锐减。1962年英国报道的病例显示,一名白血病患者的血型检测结果呈现AB、A、B、O型的混合状态,推测其A抗原表达因基因异常而部分失效。化疗药物可能加剧这种破坏,造成不可逆的血型改变。例如顺铂等药物可能直接损伤A抗原的分子结构,使A型血患者呈现B型特征。

移植则是血型永久性改变的典型场景。当A型患者接受AB型供体的造血干细胞后,患者自身红细胞逐渐被供体细胞替代,血型将完全转变为供体类型。这一过程涉及HLA配型而非ABO配型,移植后3-6个月内,患者血型会经历从混合型到单一型的转变。临床数据显示,约87%的ABO血型不合移植案例最终完成血型转换,成为"生理性嵌合体"。
三、微生物的隐秘改造
肠道菌群的异常增殖可能成为血型突变的"隐形推手"。在肠道感染场景下,某些细菌分泌的酶类具有改造红细胞抗原的能力。例如产气荚膜杆菌产生的α-半乳糖苷酶,能将B抗原末端的半乳糖切除,而脆弱拟杆菌的脱乙酰酶则专门针对A抗原的N-乙酰基。2025年东南大学的研究进一步揭示,Flavonifractor plautii的双酶系统可在5分钟内将A型红细胞转化为O型,若酶作用不完全,残留的A抗原与新生B样抗原共存,则可能呈现AB型检测结果。
这种微生物介导的血型改变具有暂时性特征。当感染得到控制后,细菌酶活性消失,红细胞抗原逐渐恢复原有结构。临床统计显示,约68%的"获得性B抗原"患者在抗感染治疗3周后血型复原。但需警惕的是,某些耐药菌株可能引发持续性抗原修饰,导致血型检测长期异常。

四、技术突破与人工干预
现代生物技术为血型定向改造提供了新思路。2018年加拿大团队利用肠道菌酶实现A→O型转换,转化效率较传统方法提升30倍。2025年中国科学家在此基础上,通过蛋白质工程构建融合酶FpGalNAcDeAc-FpGalNase,使A型血转化效率达到99%,且首次解析了酶的三维结构,为精准控制抗原修饰程度奠定基础。这意味着通过调控酶作用时间,理论上可控制A抗原向B抗原的转化比例,人工制造AB型血细胞。
该技术的临床应用仍面临挑战。改造后的红细胞存活周期缩短约15%,且可能引发免疫排斥反应。但动物实验显示,经酶处理的A→B型红细胞在小鼠体内存活率达82%,为未来开发通用型人工血制品提供了可能。
五、检测误差的识别与规避
约23%的血型改变案例实为检测误差。新生儿因抗原发育不全、老年人因抗原表达减弱,可能造成A型误判为O型。输注右旋糖酐等胶体溶液会吸附红细胞表面抗原,导致A型暂时"隐形",若此时患者体内存在获得性B抗原,可能误检为AB型。
精确鉴别需采用多重检测技术:通过吸收放散试验可区分抗原减弱与真实变异;分子生物学检测能识别ABO基因型;抗-H试剂则可排除孟买型血干扰。2024年河北血液中心的实践表明,联合血清学与基因检测可使误诊率从12%降至1.8%。
血型从A向AB或B型的转变,是基因表达、微生物活动、医疗干预等多因素交织的复杂现象。其本质在于红细胞抗原的分子修饰,既可源于病理状态的被动改变,也可通过生物技术主动调控。这种转变对输血安全、器官移植配型等领域产生深远影响,例如移植患者的血型监测需持续至术后1年,而酶改造血液的临床应用仍需完善安全性评估。
未来研究应聚焦于三方面:一是开发高特异性酶制剂以减少血型改造的副作用;二是建立动态血型数据库以追踪患者的抗原变化轨迹;三是探索血型转换与免疫系统的相互作用机制。正如诺贝尔奖得主兰德施泰纳所言:"血液的秘密远未被完全揭示",对ABO血型可塑性的深入研究,将继续推动输血医学的革新。