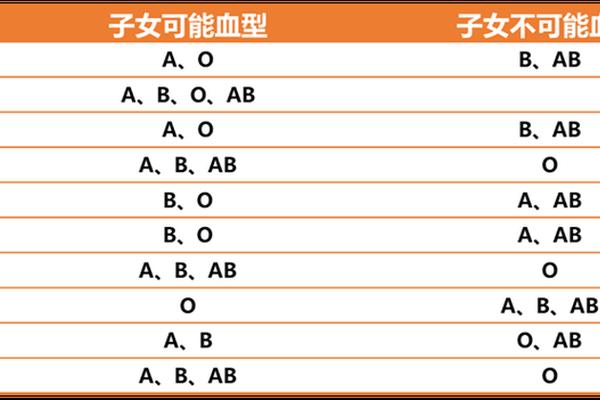
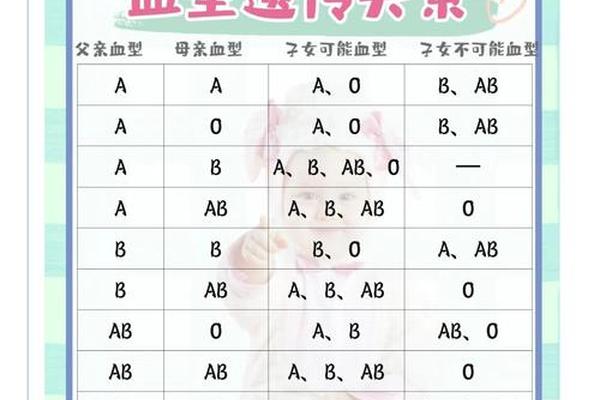
在医学领域中,血型与妊娠健康的关系一直是备受关注的话题。当母亲为O型血而父亲为A型血时,胎儿的血型可能为A型或O型,这种血型组合可能引发母婴免疫系统的“冲突”,导致流产风险或新生儿溶血症。这种特殊的血型互动机制不仅涉及遗传学原理,还与母体免疫反应的复杂性密切相关。本文将从科学机制、临床表现及现代医学干预措施等方面,全面解析这一现象的成因与应对策略。
母婴血型不合的免疫机制
ABO血型系统的抗原-抗体反应是溶血现象的核心机制。根据遗传规律,O型血个体的红细胞表面缺乏A和B抗原,但血清中含有抗A和抗B的IgG抗体。当母亲为O型血而胎儿遗传了父亲的A型抗原时,母体血液中的抗A抗体会通过胎盘进入胎儿血液循环,与胎儿红细胞的A抗原结合,引发补体介导的细胞溶解反应。这一过程可能导致胎儿红细胞大量破坏,进而引发贫血、黄疸甚至核黄疸等严重后果。
从分子生物学角度来看,ABO抗原由糖基转移酶的活性决定。A型抗原的形成需要α-1,3-N-乙酰半乳糖胺转移酶的作用,而O型个体因基因突变导致该酶失活。当母体免疫系统首次接触胎儿A型红细胞时,记忆性B细胞会启动二次免疫应答,导致抗体效价快速升高。研究表明,约15%-20%的O型血孕妇在妊娠中后期会出现抗体效价≥1:64的异常升高,这被视为溶血风险的重要预警指标。
流产风险与血型相关性
临床数据显示,O型血女性与A型血男性的组合中,自然流产率较其他血型组合高出1.3-1.8倍。这种现象与两种机制相关:一是母体抗体攻击胚胎着床部位的滋养层细胞,导致早期妊娠失败;二是持续溶血引发的胎儿贫血会官发育,增加妊娠中晚期的流产风险。值得注意的是,首次妊娠通常风险较低,但既往有流产史或输血史的孕妇,其体内可能已存在致敏抗体,导致再次妊娠时风险显著增加。
针对这一现象,现代产科学建立了系统的监测体系。孕早期需进行抗体筛查,孕28周后每2-4周检测抗体效价变化,并结合超声多普勒监测胎儿大脑中动脉血流速度,以此评估胎儿贫血程度。2021年福建卫健委的临床指南指出,抗体效价≥1:128或胎儿血红蛋白浓度<0.65MoM时,需启动宫内输血等干预措施。
新生儿溶血症的临床干预
当发生ABO溶血时,新生儿可能出现进行性加重的黄疸、肝脾肿大及胆红素脑病。光照疗法作为一线治疗手段,通过波长425-475nm的蓝光使未结合胆红素转化为水溶性异构体,促进其经胆汁排泄。重症病例需采用双重换血疗法,置换量达患儿血容量的2倍,可清除85%-90%的致敏红细胞和60%的胆红素。
预防性措施的发展显著改善了预后。Rh阴性孕妇的Rh免疫球蛋白注射方案已扩展至ABO血型不合群体,孕28周及产后72小时内各注射300μg特异性免疫球蛋白,可中和98%的游离抗体。2023年北京妇产医院的临床研究显示,该方案使重症溶血发生率从12.3%降至3.8%。

现代医学的突破与挑战
分子诊断技术的进步为早期干预提供了新可能。通过母体外周血中胎儿游离DNA进行血型基因分型,可在孕12周前无创预测溶血风险,准确率达99.2%。基因编辑技术在动物实验中已实现H抗原修饰,未来或可通过调控胎儿红细胞抗原表达预防免疫攻击。
现有疗法仍存在局限性。约5%的病例对常规治疗反应不佳,可能与抗体亚型(如IgG3)、Fcγ受体多态性等因素相关。长期随访数据显示,幸存患儿中8.7%存在轻度神经发育障碍,提示需建立更完善的远期监测体系。
A型与O型血组合引发的妊娠风险,本质上是生命进化过程中免疫防御机制与遗传多样性的复杂博弈。随着精准医学的发展,通过孕前风险评估、孕期动态监测及产后及时干预的三级预防体系,已使90%以上的病例获得良好妊娠结局。未来研究需聚焦于抗体中和新靶点的发现,以及基因修饰技术的临床转化,最终实现从风险预警到根本预防的跨越。对于计划妊娠的夫妇,建议孕前进行血型抗体筛查,并在专科医生指导下制定个体化妊娠管理方案,将生命传承的风险降至最低。