人类血液的奥秘不仅隐藏在ABO抗原中,更与Rh因子形成精密的双重密码系统。当我们在体检报告上看到"A+"或"A-"的标识时,这实际上是ABO血型系统与Rh血型系统共同作用的结果。其中"A"代表红细胞表面存在A型抗原,而"+"或"-"则揭示了RhD抗原的有无。这种双重标记体系自1940年Rh血型发现以来,已成为现代输血医学的基石。
ABO系统的分子密码
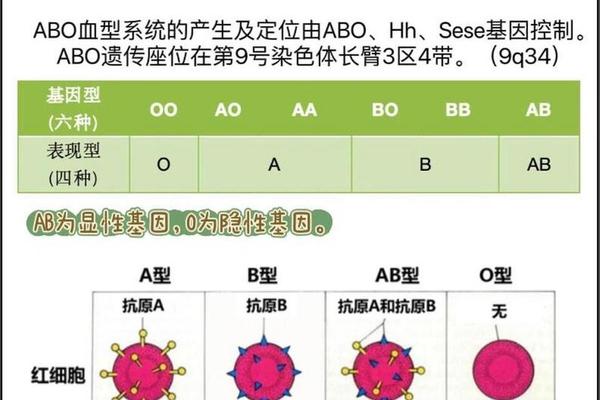
ABO血型的本质差异源于红细胞表面糖链结构的细微变化。在遗传基因调控下,A型红细胞通过N-乙酰半乳糖胺转移酶的作用,在H抗原末端添加特定糖基形成A抗原。这种分子结构差异不仅决定了血型分类,更影响着输血相容性——A型个体血清中天然存在抗B抗体,与B型或AB型血液接触时会发生致命性溶血反应。
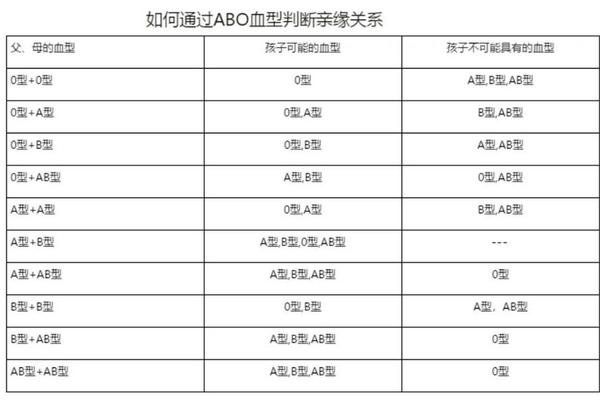
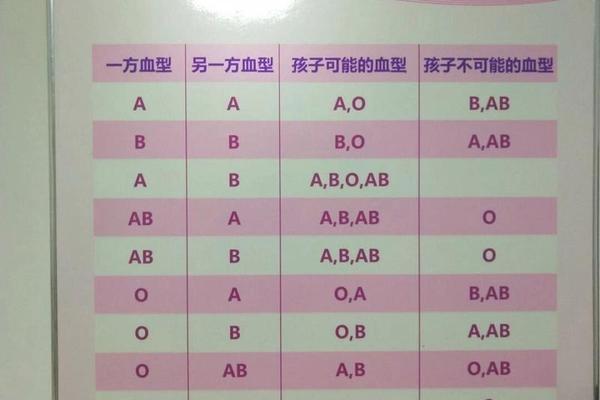
基因位点的显隐性规律造就了ABO系统的遗传特性。当个体携带两个A等位基因(AA)或一个A与一个O基因(AO)时,均表现为A型血。这种遗传稳定性使得血型在正常情况下终身不变,但近年研究发现,某些病理状态可能引发抗原表达的暂时性改变。例如白血病患者的红细胞可能因抗原减弱被误判为O型,这类生物学现象为理解血型可塑性提供了新视角。
Rh因子的免疫特性
Rh血型系统的发现源自恒河猴实验,其临床意义在于D抗原的强免疫原性。Rh阳性(+)意味着红细胞表面存在D抗原蛋白,而阴性(-)则完全缺失该抗原。这种差异在妊娠和输血中尤为重要——Rh阴性个体接触阳性血液后,可能产生IgG型抗D抗体,这种抗体能通过胎盘引发新生儿溶血病。

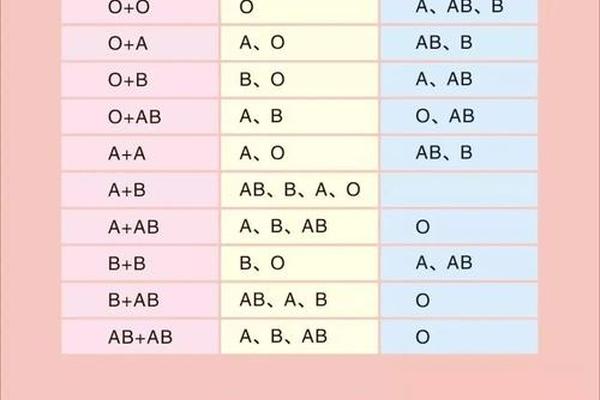
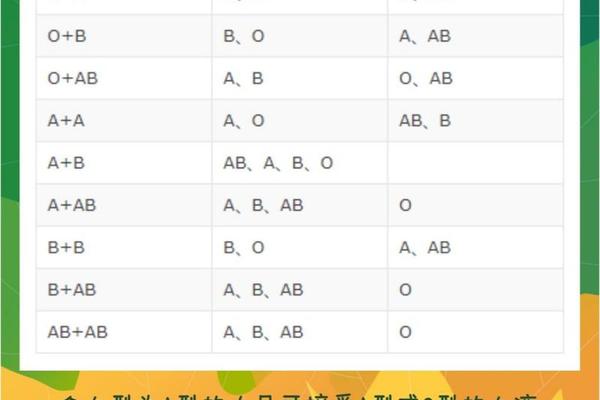
在临床实践中,A+血型约占比32%,而A-仅占6%。这种分布差异导致A-血液的储备常面临挑战。值得注意的是,Rh阴性并非单纯"稀有",其输血策略需要特殊考量:A-患者可接受A-或O-血液,而A+患者若输入A-血液虽无即时危险,但可能刺激免疫系统产生抗体。
血型改造的技术突破
近年生物酶技术的突破为血型转换带来曙光。科学家从肠道菌群Flavonifractor plautii中提取的两种酶,能精准切除A抗原末端的N-乙酰半乳糖胺,将其转化为通用O型血。这种酶促反应在常温下即可完成,且转化效率达到99.9%,相较早期咖啡豆酶法具有显著进步。
更引人注目的是2022年剑桥大学的器官血型改造实验。研究者通过灌注含特异性酶的保存液,成功将A型肾脏转换为O型,这项突破使器官分配不再受血型限制。但技术转化仍面临挑战:酶制剂纯度可能引发免疫反应,残留抗原片段仍需精密检测。
血型系统的临床新认知
传统认知中,O型血浆因含抗A/B抗体被视为"危险供体"。但最新研究揭示,通过纳米膜过滤技术可选择性去除IgM抗体,保留有益凝血因子。这种改良型O型血浆已进入Ⅲ期临床试验,有望突破现行输血规范。
对于亚型的认知也在深化。A型存在20余种亚型,其中A3型因抗原表位变异常导致血型误判。基因测序技术的应用使这类稀有血型鉴定准确率提升至99.99%,无锡血站通过荧光PCR技术已成功鉴别多例ABO亚型,为精准输血提供保障。
未来展望与挑战
血型研究正迈向分子编辑的新纪元。CRISPR基因编辑技术在小鼠实验中已实现造血干细胞ABO基因的定向修饰,这种"一次编辑、终身通用"的策略可能彻底改变血液供应模式。但问题和脱靶效应仍是主要障碍。
临床转化需建立多维度评估体系:既要考虑酶法改造的经济性(当前成本为常规血液的3倍),也要完善改造血液的长期安全性数据。2024年启动的全球多中心研究将跟踪10万例转化血液受者,重点监测迟发性免疫反应和红细胞寿命变化。
从Landsteiner发现ABO血型至今,人类用百年时间破解了血液的免疫密码,又用二十年开启了对这个密码的重编程。当血型转换从实验室走向临床,我们不仅需要技术创新,更要建立与之匹配的规范和安全标准。这项突破最终能否兑现"无限血液供应"的承诺,取决于科学共同体在技术跃进与风险管控间找到平衡点。