人类ABO血型系统的核心在于红细胞表面抗原与血清中抗体的特异性对应关系。A型血作为该系统的典型代表,其红细胞膜上表达A抗原,而血清中则天然存在抗B抗体。这种抗原-抗体的精确匹配不仅是输血医学的基石,更是免疫系统维持稳态的重要机制。自1900年兰德施泰纳发现ABO血型以来,科学家已揭示其分子遗传学机制:A抗原的形成依赖于糖基转移酶对H抗原的修饰,而抗B抗体的产生则与环境中类似抗原的免疫刺激相关。这种生物学特性使得A型血在临床输血、器官移植和疾病易感性等领域具有独特意义。
抗原的分子结构与形成机制
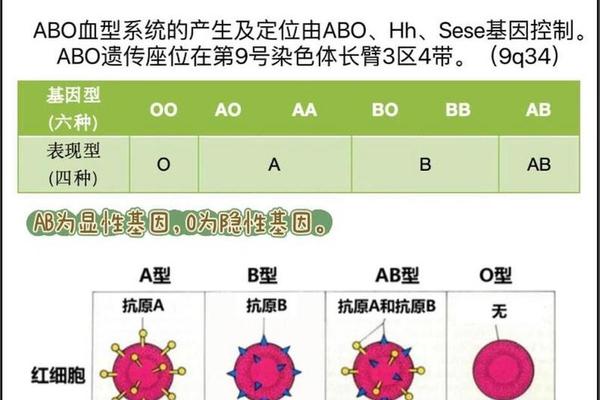
A抗原的分子基础源于糖链的精密修饰。所有ABO血型的红细胞均以H抗原为前体物质,该结构由β-D-半乳糖、β-D-N-乙酰葡萄糖胺和α-L-岩藻糖构成。在A型个体中,9号染色体上的IA等位基因编码α-1,3N-乙酰氨基半乳糖转移酶,该酶将N-乙酰半乳糖胺连接到H抗原的末端半乳糖上,形成独特的A抗原表位。这种糖基化过程具有高度特异性,实验显示,若将B型个体的血清(含α-1,3-D-半乳糖转移酶)加入A型红细胞培养体系,抗原类型并不会发生改变,证实了酶促反应的严格定向性。
抗原表达的多样性在临床实践中尤为重要。研究发现,A型存在至少20种亚型,其中A1亚型占80%以上。A1与A2亚型的区别在于红细胞表面抗原密度:A1型每细胞含81-117万个A抗原位点,而A2型仅24-29万个。这种差异源于IA基因第7外显子的单核苷酸突变,导致转移酶活性降低。临床输血时,亚型差异可能引发弱凝集反应,因此精准的血型鉴定需结合抗A1凝集素试验。
血清学特性与免疫反应
A型血清中的抗B抗体属于IgM类免疫球蛋白,其产生机制具有进化适应性。出生时婴儿血清中尚未检测到该抗体,但在6-12月龄时因接触环境中与B抗原相似的微生物多糖(如大肠杆菌O86的类B抗原)而逐渐形成。这种自然抗体具有温度依赖性,在4℃时凝集效价最高,37℃时活性下降,这解释了为何ABO不合输血引发的溶血反应多发生在血管内而非组织间隙。
抗B抗体的临床意义在输血医学中尤为突出。当A型受血者输入B型红细胞时,抗B抗体通过Fab段与B抗原结合,激活补体系统形成膜攻击复合物,导致红细胞渗透性溶解。实验数据显示,每毫升血清中的抗B抗体可迅速裂解约5×10^8个异型红细胞。值得注意的是,O型供血者的"万能供体"称号存在局限:尽管其红细胞缺乏A/B抗原,但血清中的抗A抗体仍可能引发A型受血者的迟发性溶血反应,特别是大量输血时抗体稀释不足的情况下。
遗传学机制与群体分布
ABO血型的遗传遵循孟德尔共显性规律。A型个体的基因型可为IAIA(纯合型)或IAi(杂合型),其中i等位基因因第6外显子移码突变失去酶活性。群体遗传学研究显示,东亚人群中A型占比约28-31%,显著高于欧美人群的20-23%。这种差异可能与历史上传染病的选择压力有关:例如霍乱弧菌的脂多糖与A抗原相似,使得A型个体更易被天然抗体中和。
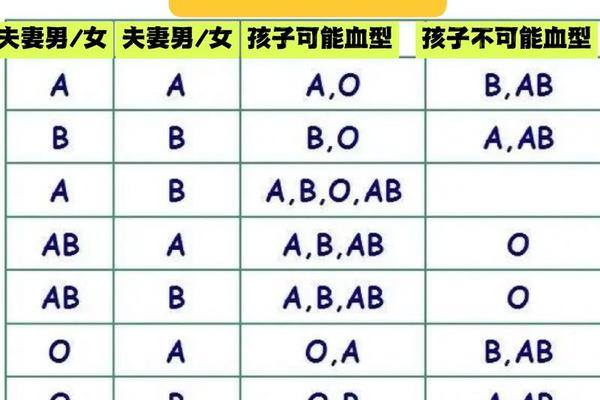
家系分析揭示了ABO系统的特殊遗传现象。若父母均为O型(ii基因型),子女必然为O型;而A型与B型结合可能产生AB型子代。这种规律曾广泛应用于亲子鉴定,但需注意孟买型(hh基因型)等稀有血型的干扰。统计显示,约0.01%的A型个体实际为Ah亚型,其红细胞缺乏H抗原导致A抗原无法表达,常规检测易误判为O型。
临床应用与前沿研究
在产科医学领域,A型血与妊娠并发症的关联引发关注。大规模队列研究表明,A型孕妇发生静脉血栓栓塞的风险较O型高1.4倍,这可能与Ⅷ因子水平升高有关。而在器官移植中,供受体ABO相容性直接影响移植物存活率。肝移植领域出现突破性进展:通过血浆置换和免疫抑制,跨血型(如A→O)移植成功率已达80%,其机制涉及供肝内皮细胞抗原的逐渐脱落。
疾病易感性方面,A型人群对某些病原体表现出独特反应。例如诺如病毒GII.4株通过结合组织血型抗原(H型)感染肠道细胞,而A抗原对该结合位点的遮蔽作用使A型个体感染风险降低40%。相反,幽门螺杆菌的BabA黏附素能特异性识别Lewis b抗原(与A抗原共表达),导致A型人群胃癌发生率升高1.2倍。
A型血的抗原抗体系统展现了生命科学的精妙平衡——既通过抗B抗体提供免疫防御,又因抗原多态性影响疾病进程。随着单细胞测序技术的发展,未来研究可深入解析抗原表达的时空差异性,例如血小板与内皮细胞的ABO抗原分布如何影响血栓形成。基因编辑技术的进步为人工调控抗原表达提供了可能,动物实验已成功将B型红细胞转化为O型,这或将彻底改变血液供给格局。对ABO系统与其他血型系统(如Rh、Kell)的交互作用研究,将成为精准医疗时代输血医学的新焦点。