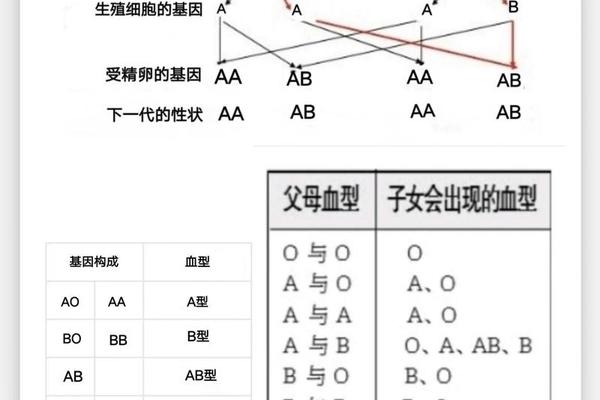
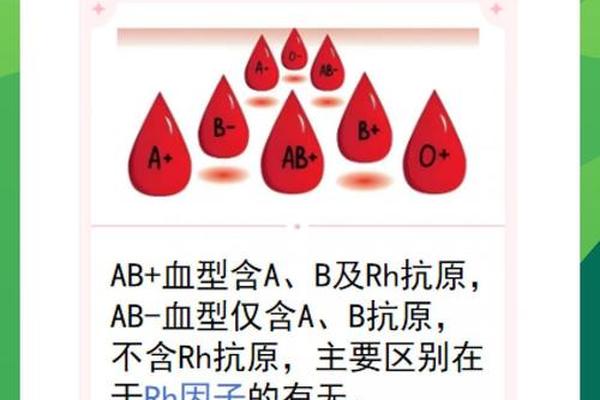
ABO血型系统与Rh血型系统是人类血液分类的两大核心框架。ABO系统根据红细胞表面是否存在A、B抗原将血液分为A型、B型、AB型和O型,而Rh系统则基于RhD抗原的有无分为Rh阳性(如A+)和Rh阴性(如A-)。这种双重分类体系不仅是临床输血配型的基石,还与母婴溶血性疾病、器官移植排斥反应等密切相关。
区分A+和A-的关键在于RhD抗原的检测。Rh阳性个体携带RhD抗原,而Rh阴性个体则缺失该抗原。这种差异源于基因表达的不同:RhD抗原由RHD基因编码,若该基因缺失或突变,则无法合成RhD抗原,导致Rh阴性表型。值得注意的是,Rh阴性血型在人群中的比例因地域而异,例如我国汉族人群中Rh阴性仅占约0.3%,因此被称为“熊猫血”。
二、血清学检测的标准化方法
血清学检测是区分A+与A-的常规手段,其核心原理是利用抗原-抗体反应的特异性。对于ABO血型的鉴定,需同时检测红细胞抗原(正向定型)和血清中的抗体(反向定型)。例如,A型血的红细胞表面含A抗原,血清中含抗B抗体;而RhD抗原的检测则需使用抗D试剂,若红细胞与抗D试剂发生凝集则为Rh阳性,否则为Rh阴性。
实际操作中,Rh阴性需通过多步骤验证。初次检测未显示凝集的样本需进一步进行间接抗球蛋白试验(IAT),以排除弱D表型的干扰。弱D表型的红细胞RhD抗原表达微弱,可能被误判为阴性,但其临床意义与典型Rh阴性不同,需通过分子检测确认。实验室需严格遵循质控标准,例如使用O型血清补充检测以避免A亚型(如Ax)误判为O型,从而间接影响Rh分型的准确性。
三、基因分型技术的精准突破
传统血清学方法存在局限性,例如无法识别部分基因变异导致的抗原表达异常。近年来,PCR-SSP(序列特异性引物聚合酶链式反应)等分子生物学技术成为补充手段。通过设计特异性引物,可精准扩增RHD基因的特定区域,从而区分Rh阳性与阴性基因型。例如,我国研发的ABO-A亚型基因分型试剂盒已实现对中国人群常见A亚型的检测,其原理是通过引物3′末端的碱基匹配差异控制扩增效率,结合内参质控确保结果可靠性。
基因检测还可揭示稀有血型的遗传机制。研究发现,亚洲人群中约70%的Rh阴性由RHD基因全缺失引起,而白种人中更常见的是RHDψ假基因或杂交基因。这种差异提示,不同人群需采用定制化的检测策略。基因分型在干细胞移植后血型转换监测、新生儿溶血病产前诊断等领域展现出独特价值,例如通过母体血液中胎儿DNA分析RhD状态,可提前评估溶血风险。
四、临床意义与风险管理
Rh阴性个体面临特殊的医疗风险。若Rh阴性女性妊娠Rh阳性胎儿,胎儿的红细胞可能通过胎盘进入母体,刺激母体产生抗D抗体,导致后续妊娠发生新生儿溶血病。Rh阴性孕妇需在孕28周和分娩后72小时内注射抗D免疫球蛋白以阻断致敏。
输血管理方面,Rh阴性患者原则上应接受Rh阴性血液。紧急情况下虽可输注Rh阳性血,但会导致约80%的受血者产生抗D抗体,影响未来输血安全。统计显示,我国A-型血误输A+型血的溶血反应发生率约为0.03%,虽低于ABO血型不合的致死率(约10%),但仍需通过交叉配血试验严格规避。
五、未来研究方向与挑战
当前研究的焦点包括:1)开发快速便携的床边检测设备,例如基于微流控芯片的联合ABO/Rh分型技术;2)探索CRISPR-Cas9基因编辑在RhD抗原人工合成中的应用,为稀有血型库扩容提供新思路;3)建立区域性稀有血型数据库,通过机器学习预测抗原表达模式。
争议亦不容忽视。例如,基因编辑可能打破自然血型分布平衡,而商业化血型数据库的隐私保护亟待立法完善。对此,学界呼吁建立跨学科协作框架,将技术创新与规范同步推进。
总结与建议
区分A+与A-的核心在于RhD抗原的精准识别,需结合血清学与基因检测技术,并根据临床场景动态调整策略。未来应加强公众科普教育,提高Rh阴性个体的健康管理意识,同时推动血型检测技术的标准化与智能化。建议医疗机构将Rh分型纳入常规产检项目,并通过政策扶持扩大稀有血型库规模,最终构建覆盖全生命周期的血型安全管理体系。