ABO血型系统是人类最早发现且临床意义最为重大的血型分类体系,其核心机制建立在红细胞表面抗原与血清抗体的特异性反应上。根据红细胞膜上A、B抗原的有无,ABO系统将人类血液划分为A型、B型、AB型和O型四种类型。其中A型携带A抗原和抗B抗体,B型携带B抗原和抗A抗体,AB型同时具有A、B抗原而无对应抗体,O型则缺乏A、B抗原但含有抗A和抗B抗体。这种抗原-抗体反应的生物学特性,使得ABO血型匹配成为输血安全和器官移植成功的决定性因素。
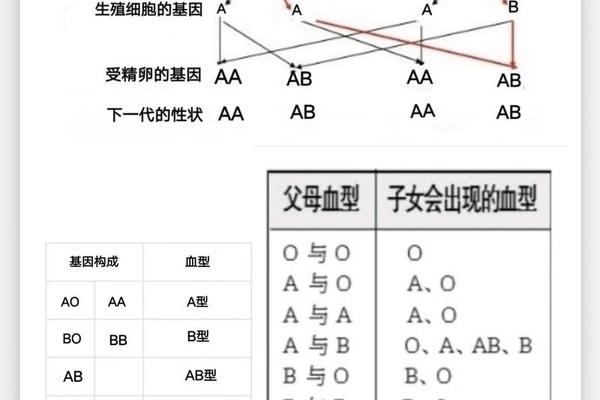
从遗传学角度分析,ABO血型由位于9号染色体上的复等位基因(IA、IB、i)控制。A型基因型为IAIA或IAi,B型为IBIB或IBi,AB型为IAIB,O型则为ii。值得注意的是,近年基因测序研究发现,部分亚型(如A2、B3等)的出现与启动子区碱基缺失或外显子点突变密切相关。例如,2024年南京儿童医院的研究团队在20例抗原表达异常样本中,发现启动子区-119C>T变异与Exon7的1054delC可能是导致抗原减弱的新型基因突变。
二、血型鉴定的技术演进
传统血型鉴定主要依赖抗原抗体反应的可见凝集现象。玻片法通过肉眼观察红细胞与标准抗血清的凝集结果,具有操作简便的优势,但存在灵敏度低(仅能检测IgM类抗体)、无法识别弱亚型等局限。试管法则通过离心加速抗原抗体结合,显著提高了检测灵敏度,尤其适用于新生儿或老年患者等抗原表达较弱的群体。
随着分子生物学的发展,凝胶微柱法和基因分型技术逐步成为主流。凝胶微柱法利用葡聚糖凝胶的分子筛效应,使凝集红细胞滞留在凝胶上层,非凝集细胞沉降至管底,通过自动化仪器判读可精确量化反应强度,灵敏度达到0.1%。而基因测序技术通过对ABO基因1-7外显子及启动子区的全面分析,不仅能准确判定常规血型,还可识别40余种稀有亚型,在疑难血型鉴定中展现出独特优势。

三、临床应用的现实挑战
在输血医学领域,ABO血型相容性原则要求供者红细胞不被受者血清抗体破坏。O型血曾被视为“万能供血者”,但其血浆中含有的抗A、抗B抗体在大剂量输血时仍可能引发溶血反应。2015版《临床输血技术规范》明确强调,异型输血仅限于急救且同型血源短缺时,输注量需控制在2单位以内,并严格监测溶血指标。对于RhD阴性(熊猫血)等稀有血型,建立区域性冰冻红细胞库和自体输血预案显得尤为重要。
器官移植领域面临更复杂的免疫屏障。除ABO抗原外,供受体间的HLA配型、抗供者特异性抗体(DSA)等因素共同影响移植物存活。日本学者山本等人发现,ABO不相容肝移植中,通过血浆置换清除天然抗体、利妥昔单抗抑制B细胞活性等联合方案,可使5年存活率达到80%以上。这提示现代免疫调节技术正在突破传统血型屏障的限制。
四、前沿研究与未来方向
近年来,生物标志物研究为血型系统开拓了新维度。2025年全球生物标志物市场规模预计突破千亿美元,其中糖基化修饰蛋白质组学可揭示ABO抗原在肿瘤微环境中的动态变化。例如,胃癌细胞表面A抗原的异常高表达与PD-1抑制剂疗效呈负相关,这为个体化免疫治疗提供了新靶点。ABO血型与疾病易感性的关联研究取得突破——全基因组关联分析(GWAS)证实,O型个体患静脉血栓风险较非O型降低30%,而AB型人群的癌发病率显著升高。
未来研究需在三个方向持续突破:一是开发微型化血型快速检测设备,结合微流控芯片技术实现急诊现场的精准分型;二是建立多组学整合数据库,将血型基因型、表观修饰与临床表型深度关联;三是探索CRISPR基因编辑技术在稀有血型红细胞体外制备中的应用,从根本上解决血源短缺问题。
ABO血型系统作为连接遗传学与临床医学的桥梁,其研究历经百年仍充满生命力。从Landsteiner发现基础凝集现象,到现代分子诊断技术的精准解析,血型鉴定不断突破技术边界,在输血安全、疾病预警、个体化治疗等领域持续发挥关键作用。面对精准医学时代的新挑战,需要跨学科协作深化血型分子机制研究,同时加强公众血型知识科普,推动献血者基因分型数据库建设,最终实现从血型匹配到个体化医疗的跨越式发展。