人类血型的分类体系是医学史上最伟大的发现之一,它不仅为输血安全奠定了基础,更揭示了基因与免疫系统的精妙互动。ABO血型系统与Rh血型系统的叠加组合,形成了如A+、A-、AB+、AB-等复杂标记,这些看似简单的字母与符号背后,蕴含着生命科学的核心密码。理解这些标记的生物学本质与临床意义,对个体健康管理具有深远影响。
ABO系统中的A型与AB型
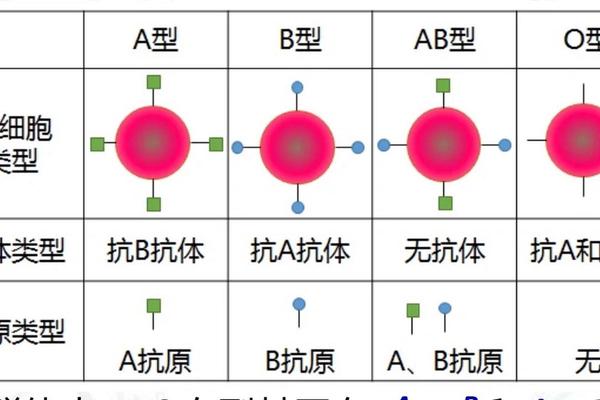
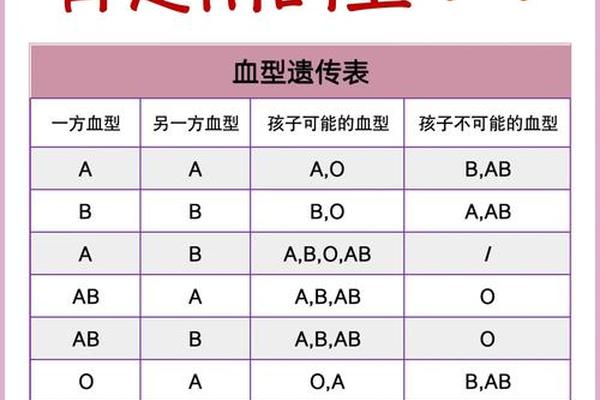
ABO血型系统的核心在于红细胞表面抗原的差异。A型血的红细胞携带A抗原,血清中含有抗B抗体;AB型血则同时携带A、B抗原,血清中不含有抗A或抗B抗体。这种抗原-抗体的反向分布决定了输血相容性:A型血可接受A型或O型供血,而AB型因缺乏抗体可接受所有血型,故被称为"万能受血者"。
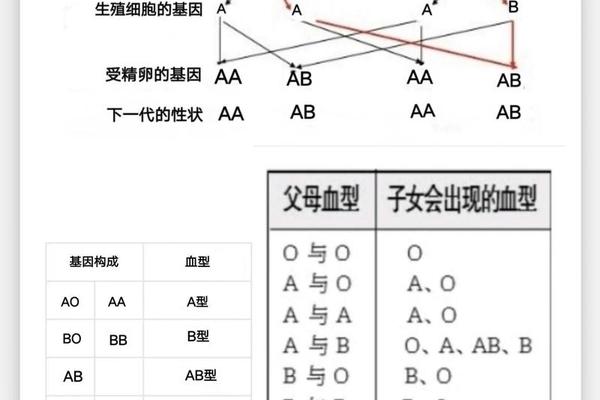
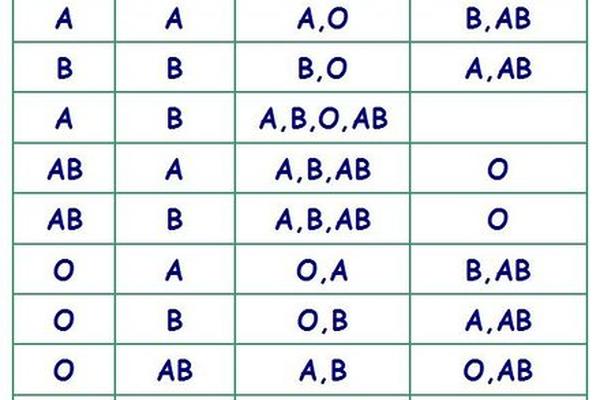
从遗传学角度,A型血由IA基因主导,基因型可能是IAIA(纯合)或IAi(杂合),而AB型必须继承父母的IA和IB基因。这解释了为何A型与B型父母可能诞下AB型后代,但A型与O型父母的子女只能是A或O型。值得注意的是,A型存在20余种亚型,如A1、A2等,其中A2亚型因抗原表达较弱,常规检测中可能被误判为O型。这种生物学复杂性要求临床血型鉴定必须采用正反定型结合的标准化流程。
Rh系统中的+/-符号解析
Rh血型系统的核心在于红细胞是否携带D抗原。A+表示携带D抗原(Rh阳性),A-则缺失D抗原(Rh阴性)。这种区分具有重要临床价值:Rh阴性个体输入Rh阳性血液时,会产生抗D抗体,引发溶血反应。全球Rh阴性血型比例存在显著地域差异,欧美人群约占15%,而中国汉族人群仅为0.3%。
Rh血型的遗传遵循隐性规律,父母双方必须同时携带隐性基因才会诞下Rh阴性子女。这种遗传特性使得Rh阴性血型在家族中呈现隔代遗传现象。对于妊娠期女性,Rh阴性母亲若怀有Rh阳性胎儿,可能因胎母输血导致抗体产生,威胁后续妊娠安全。现代医学通过抗D免疫球蛋白注射,已能将新生儿溶血症发生率从14%降至1%以下。
基因层面的本质差异
ABO基因位于9号染色体,其IA、IB、i等位基因通过编码糖基转移酶决定抗原类型。A型个体通过IA基因合成N-乙酰半乳糖胺转移酶,将H抗原转化为A抗原;AB型则同时表达两种酶系统。Rh系统的D抗原由1号染色体上的RHD基因控制,该基因的缺失或突变导致Rh阴性表型。
分子诊断技术的发展揭示了更深层的遗传多样性。例如,2023年武汉报道的A2亚型案例显示,基因外显子6的261delG突变和7号外显子的467C>T突变,导致抗原表达异常。这种基因层面的细微差异,解释了为何传统血清学检测可能产生0.12%的误判率。当前全基因组测序技术已能精确识别300余种ABO等位基因,为精准医疗提供新可能。
临床实践中的鉴别要点
在输血医学中,A+与A-的区分关乎生命安危。Rh阴性患者必须输注Rh阴性血液,紧急情况下虽可接受Rh阳性血,但会永久致敏免疫系统。对于AB型患者,虽然理论上是万能受血者,但临床发现约30%的AB型血浆中含有不规则抗体,因此仍需优先选择AB型供血。
孕产期血型管理要求更严苛。Rh阴性孕妇需在妊娠28周和分娩后72小时内注射抗D球蛋白,预防同种免疫反应。而AB型孕妇若存在抗A1抗体,可能引发胎儿溶血,这需要通过抗体效价监测和产前干预。近年来,微柱凝胶技术的应用将血型鉴定准确率提升至99.98%,但亚型检测仍需依赖基因测序。
血型系统的复杂性远超字母符号的表象,A、AB型与+/-符号的组合,实质是抗原表达、基因型组合、免疫应答等多重生物学过程的综合体现。随着单细胞测序技术的发展,未来血型鉴定将进入分子诊断时代,不仅能识别传统亚型,更能预测输血反应风险。建议医疗机构建立血型基因数据库,推广液态芯片技术,同时加强公众对稀有血型的认知。对于个体而言,准确掌握自身血型信息,既是生命安全的保障,更是对人类生命密码的深刻认知。