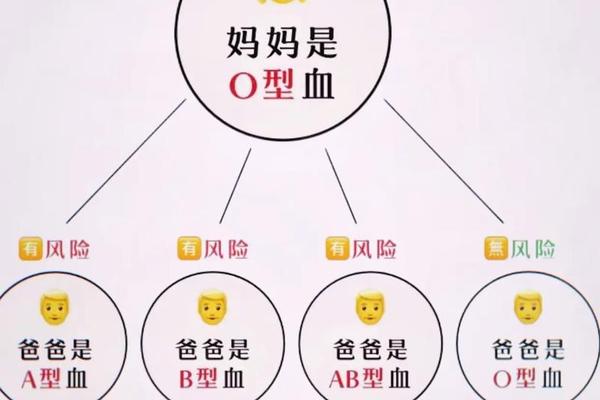
在人类遗传学中,血型的传递遵循特定的遗传规律。当O型血女性与A型血男性结合时,其子女可能遗传父亲携带的A抗原,形成母婴ABO血型不合的特殊情况。这种生物学现象可能触发母体免疫系统对胎儿红细胞的攻击,导致新生儿溶血病(HDN)的发生。据临床数据显示,我国约30%的新生儿溶血症属于ABO溶血类型,其中母体为O型、胎儿为A型的情况占比最高。
遗传机制与免疫应答
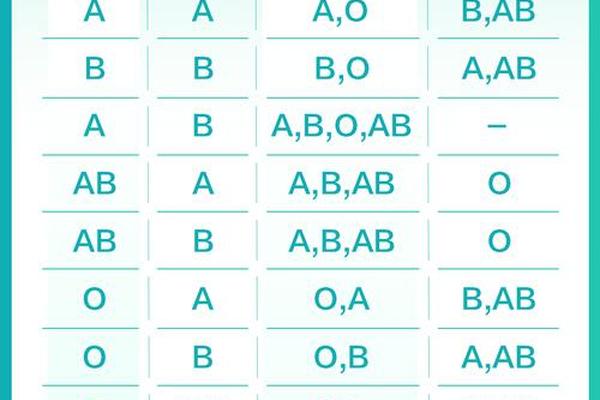
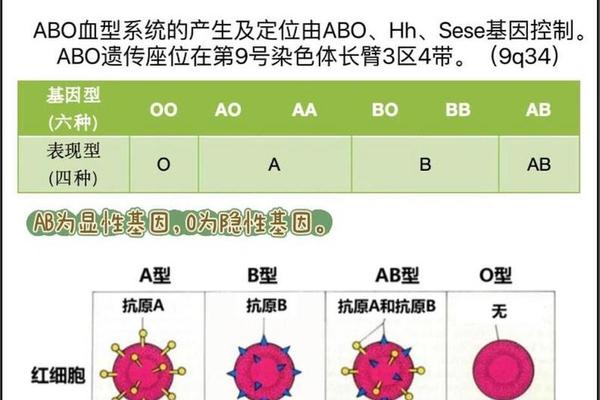
ABO血型系统的遗传遵循孟德尔定律。O型血个体携带两个隐性等位基因(ii),而A型血个体可能携带AA或Ai基因型。当父方为显性纯合子(AA)时,子女必然携带A抗原;若父方为杂合子(Ai),则有50%概率遗传A抗原。母体O型血中天然存在的抗A免疫球蛋白G(IgG)可通过胎盘屏障,与胎儿A型红细胞表面的A抗原结合,引发补体介导的红细胞溶解。
这种免疫反应存在"致敏-再激活"的双阶段特性。约半数O型血女性在妊娠16周后即可检出抗A抗体效价升高,这与胎儿红细胞通过胎盘绒毛间隙进入母体循环有关。值得关注的是,自然界广泛存在的类A抗原物质(如某些细菌多糖)可能使部分未孕女性已产生基础抗体,导致ABO溶血在第一胎即可发生。
临床表现与疾病进程
新生儿ABO溶血主要表现为黄疸、贫血和肝脾肿大三联征。约25%患儿在出生24小时内即出现肉眼可见的黄疸,其血清总胆红素水平常以每日5mg/dL的速度递增,显著高于生理性黄疸的上升幅度。重症病例可能发展为核黄疸,表现为肌张力异常、惊厥等神经系统损伤症状,这类后遗症在未及时治疗患儿中的发生率可达7%。
实验室检查可发现特征性改变:网织红细胞比例升高(>6%)、外周血涂片出现球形红细胞、直接抗人球蛋白试验(DAT)呈弱阳性。值得注意的是,约30%的ABO溶血患儿DAT检测呈假阴性,这与胎儿红细胞表面抗原位点较少导致的抗体结合量不足有关,需结合游离抗体试验进行综合判断。
产前监测与诊断策略
现代产前筛查体系已形成三级预防网络。首次抗体效价检测应在妊娠16周完成,当抗A效价≥1:64时提示高风险。动态监测发现效价呈现4倍以上增长或突破1:512阈值时,需启动胎儿贫血评估程序。超声多普勒检测大脑中动脉收缩期峰值流速(MCA-PSV)是当前无创诊断胎儿贫血的金标准,其灵敏度达88%。
基因检测技术的发展为精准防控提供新路径。通过母体外周血中游离胎儿DNA(cffDNA)进行血型基因分型,可在妊娠10周时无创判断胎儿血型,使高风险孕妇的早期识别率提升至98%。对于确诊ABO溶血的胎儿,妊娠28周后每周进行羊水胆红素检测,可动态评估溶血严重程度。
治疗手段与预后管理
光照疗法仍是新生儿期的主要干预措施,采用波长425-475nm的蓝光可使胆红素分子发生结构异构化,水溶性增加200倍以促进排泄。对于血清总胆红素>25mg/dL的危重患儿,换血疗法可快速清除致敏红细胞和游离抗体,将核黄疸发生率降低至1%以下。
远期随访数据显示,接受规范治疗的ABO溶血患儿在3岁时的神经发育评估与健康儿童无统计学差异。但需注意约15%患儿可能出现代偿性造血功能亢进,表现为出生后2-6周血红蛋白进行性下降,这类"晚期贫血"病例需持续补铁治疗至出生后6个月。
研究展望与临床启示
近年研究发现,母体Fcγ受体IIB基因多态性与抗体穿越胎盘的能力存在相关性,这为个体化风险评估提供了分子生物学依据。单克隆抗体技术制备的anti-A免疫吸附柱已进入临床试验阶段,可通过体外血浆置换选择性清除致病抗体。
对于O型血女性与A型血男性的婚育群体,建议在孕前进行血型血清学全面检测,妊娠期建立抗体效价动态档案。临床实践证实,这种主动监测模式可使重度ABO溶血发生率下降76%,将需要换血治疗的病例控制在0.3%以下。通过多学科协作的全程化管理,ABO溶血已从曾经的产科危重症转变为可防可控的常规疾病。