在医学领域,关于血型与疾病关联的研究始终充满争议。一位A型血的父亲罹患癌症,而其配偶为O型血的案例,引发了人们对血型与癌症遗传机制的关注。ABO血型系统作为人类最基础的遗传特征之一,其抗原表达不仅影响输血兼容性,更可能通过免疫调节、病原体感染等途径间接影响癌症发生概率。近年来多项研究指出,A型血人群在胃癌、癌等消化道肿瘤中呈现更高的风险倾向,而O型血则表现出一定保护作用。这一现象是否与血型基因的显隐性遗传规律相关?父母血型组合又如何影响后代健康?本文将从遗传机制、环境交互、临床数据等角度展开分析。
血型抗原的生物学机制

血型抗原的本质是红细胞表面由特定基因编码的糖蛋白或多糖结构。A型血个体携带A抗原,其形成依赖于A等位基因(显性)的存在;O型血则因隐性纯合(ii)而无A/B抗原表达。研究显示,A抗原可能通过促进幽门螺杆菌等致癌病原体的黏附,增加消化道黏膜的慢性炎症风险。例如,A型血人群胃内幽门螺杆菌感染率显著高于其他血型,而该菌感染是胃癌的明确诱因。A抗原与某些肿瘤细胞表面蛋白的相似性,可能干扰免疫系统对癌细胞的识别能力,导致免疫逃逸。上海交通大学团队长达20年的跟踪研究发现,A型血人群患胃癌、结直肠癌的风险较非A型血人群增加12%,提示抗原-免疫互作在致癌过程中的关键作用。
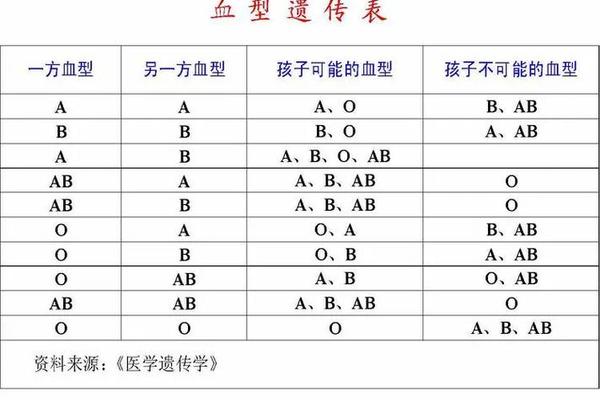
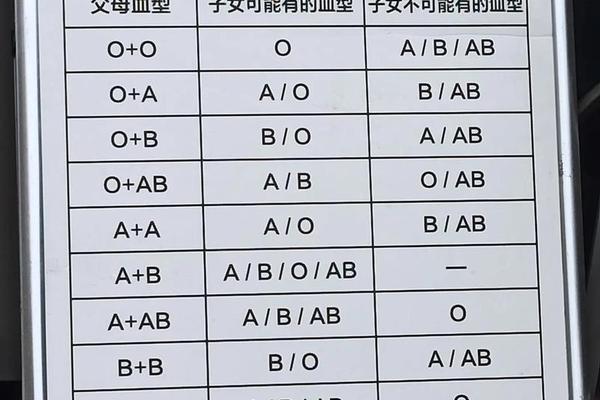
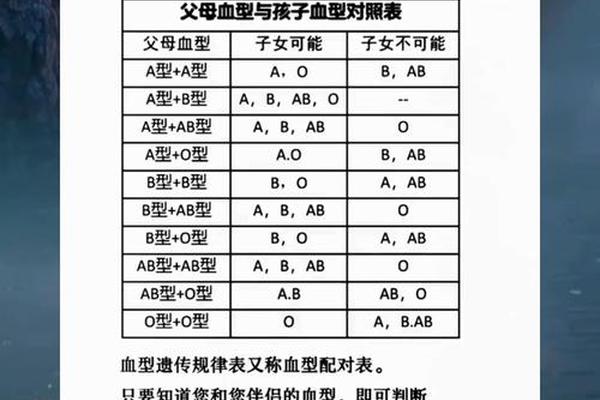
父母血型的遗传交互
父亲为A型血(基因型AA或AO)、母亲为O型血(基因型OO)的遗传组合,决定了子女血型只能是A型(AO)或O型(OO)。从孟德尔遗传规律分析,A型血子女携带的A基因来自父亲,O基因来自母亲。这种遗传特征可能通过两条路径影响癌症风险:其一,A等位基因可能调控炎症因子(如IL-6、TNF-α)的表达水平,导致慢性炎症微环境形成;其二,O型基因携带者因缺乏A/B抗原,可能具有更强的NK细胞活性,从而提升对癌变细胞的免疫监视能力。日本东京医科大学的研究进一步发现,A型血癌症患者术后复发率高达35%,显著高于O型血患者的17%,提示血型基因可能影响肿瘤生物学行为。
环境因素的协同作用
血型与癌症的关联始终与环境暴露存在复杂交互。针对A型血人群的研究表明,其胃癌高发风险在吸烟、高盐饮食群体中尤为显著。例如,摄入腌制食品中的亚硝酸盐会与A型胃黏膜特有的糖基化酶发生反应,生成具有基因毒性的N-亚硝基化合物。而O型血个体因胃酸分泌量较高,能更有效抑制此类致癌物形成。A型血特有的凝血因子Ⅷ水平升高,可能通过促进肿瘤血管生成加速癌症进展。这种生物学特性在久坐、肥胖人群中表现更为明显,说明生活方式干预对A型血人群具有特殊意义。
健康管理的精准策略
基于血型的癌症风险管理需采取分层策略。对A型血人群,建议将胃镜检查起始年龄提前至35岁,并定期检测幽门螺杆菌感染。饮食方面需严格控制红肉摄入(每周<300g),增加富含维生素C的果蔬以阻断亚硝胺合成。瑞典卡罗林斯卡医学院的队列研究表明,A型血人群每日补充500mg维生素C可使胃癌风险降低22%。对于O型血配偶,尽管其自身患癌风险较低,但需关注子代A型血成员的早期筛查。基因检测技术的发展为血型-癌症关联研究提供新工具,如ABO基因单核苷酸多态性(SNP)分析已用于评估癌易感性。
现有证据表明,A型血人群的癌症风险升高是遗传易感性与环境暴露共同作用的结果。父亲A型血与母亲O型血的组合,使子代具有明确的A/O基因型特征,这为家族癌症风险评估提供了新视角。未来研究需在三个方向深入:一是建立血型特异性生物标志物体系,实现癌症早期预警;二是解析ABO基因与癌基因(如TP53、KRAS)的协同突变机制;三是开发针对A抗原的免疫干预疗法。尽管血型不可改变,但通过个性化筛查、营养干预和生活方式调整,仍能有效降低A型血人群的患癌风险。正如世界癌症研究基金会强调,科学认知血型风险应转化为积极预防行动,而非制造健康焦虑。