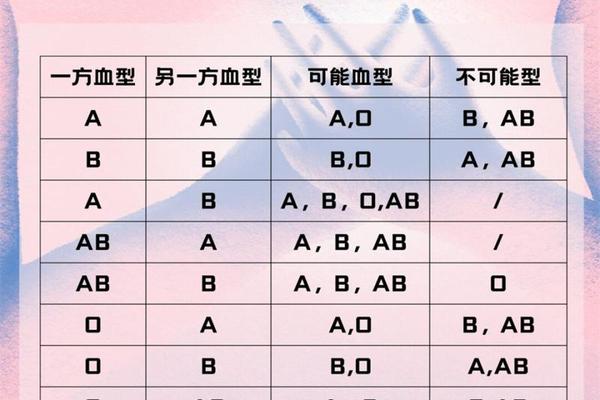
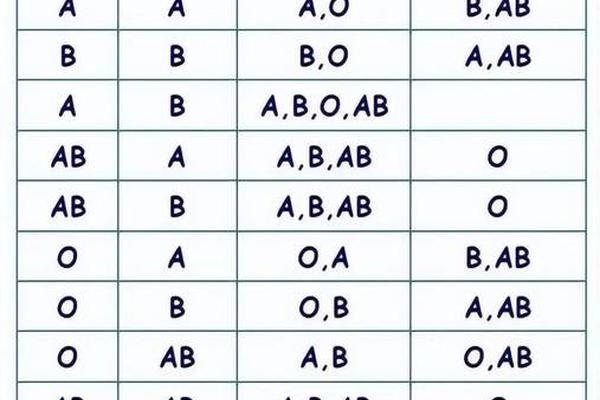
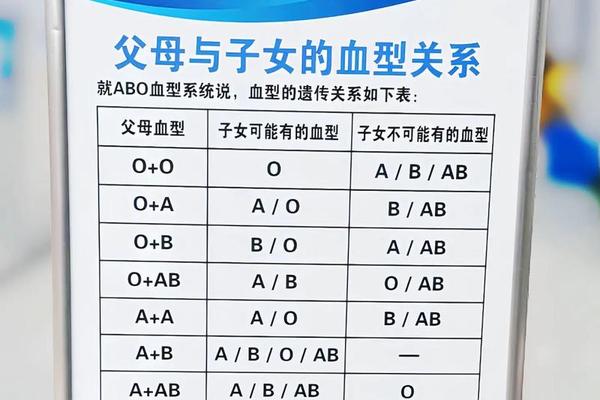
A3亚型是ABO血型系统中A型抗原的罕见变异体,其核心特征表现为红细胞表面A抗原的弱表达。血清学检测中,A3型红细胞与抗A试剂反应时呈现“混合视野凝集”(即部分细胞凝集、部分不凝集的状态),这一现象成为其区别于其他A亚型的关键标志。例如,A2型虽抗原强度较弱,但凝集反应均匀;而A3型的混合凝集模式提示其红细胞群体中存在抗原表达的异质性。
从抗原强度分析,A3型红细胞的A抗原数量显著低于常规A1型(成人A1型红细胞抗原数为81-117万,而A3型仅为7-10万)。这种弱表达特性源于ABO基因的特定突变,导致糖基转移酶活性降低,影响A抗原的完整合成。值得注意的是,A3型个体血清中通常不含有抗A或抗A1抗体,但在极少数案例中可能检测到低温反应性不规则抗体,这对输血安全构成潜在风险。
二、遗传机制与分子基础
A3亚型的遗传基础涉及ABO基因的复杂变异。研究表明,ABO基因第6、7外显子的单核苷酸多态性(SNP)可能改变糖基转移酶的结构,从而削弱其催化半乳糖胺转移的能力。例如,c.467C>T和c.745C>T突变已被证实与A抗原表达减弱相关。启动子区域-119位点的C>T变异可能通过调控基因转录效率,进一步影响抗原合成水平。
家系研究显示,A3型的遗传模式符合孟德尔共显性规律。在一项针对20例ABO抗原异常表达的基因分析中,发现部分A3型个体携带ABOA3.01等位基因,该基因型在酶活性检测中显示仅为正常A1型的10%-15%。这种基因型-表型的对应关系,为临床分子诊断提供了重要依据,但也提示当前基因分型技术仍需完善——约20%的A3型样本尚未发现明确的基因突变位点,暗示可能存在未被识别的调控机制或表观遗传因素。
三、临床检测挑战与解决方案
在常规血型鉴定中,A3亚型易被误判为O型或Aweak型。其正定型反应强度弱(通常≤2+),且混合视野特征在玻片法中易被忽视。研究数据显示,使用试管法结合4℃增强技术,可将A3型检出率提高3倍以上。对于疑难样本,推荐采用三步确认法:首先通过抗H试剂验证(A3型H抗原反应强度达4+);继而用双花扁豆凝集素排除A1抗原;最后通过吸收放散试验证实微量A抗原的存在。
输血实践中,A3型个体需特殊对待。因其红细胞抗原弱,作为供者时需按O型处理;作为受者则需输注A型或O型洗涤红细胞。值得注意的是,约0.3%的A3型血浆中含有抗A1抗体,此类抗体在37℃仍具活性,可能引发急性溶血反应,因此交叉配血时必须采用抗球蛋白法进行严格验证。
四、群体分布与人类学意义
全球流行病学调查显示,A3亚型呈现显著的地域差异。在欧洲人群中检出率约为1/15万,而在中国上海地区的频率更低至1/15万,且存在南北梯度差异——华北地区检出率较华南高2.3倍。这种分布特征可能与历史迁徙过程中的遗传漂变有关,例如蒙古人种基因池中特定的ABO单倍型频率,可能抑制了A3型等位基因的扩散。
从人类进化视角分析,A3亚型的存续可能具有适应性意义。有假说认为,弱A抗原表达可降低某些病原体(如霍乱弧菌)的感染风险,这种选择压力在特定生态环境中维持了A3型的低频存在。支持这一假说的证据来自分子模拟研究:A3型红细胞表面抗原与霍乱毒素结合位点的亲和力较A1型降低76%。
五、未来研究方向与临床启示
当前对A3亚型的研究仍存在三大盲区:其一,约30%的血清学确诊案例缺乏对应的基因突变证据,提示需要开发更灵敏的深度测序技术;其二,A3型与肿瘤抗原表达的相关性尚未明确,基础研究显示弱ABO抗原可能影响癌细胞免疫逃逸机制;其三,现有输血策略对A3型个体的长期健康影响缺乏追踪数据。
建议临床机构建立A3型专属数据库,收录其基因型、抗体特征及输血反应案例。在检测技术层面,应推广分子诊断与血清学联合检测方案,特别是在器官移植和妊娠管理领域。对于已确诊的A3型个体,需开展定期抗体筛查,并提供遗传咨询服务——虽然A3型本身不构成健康威胁,但其与某些孟买型等位基因的组合可能引发严重的溶血性疾病。