血型系统的复杂性远超一般公众的认知,ABO血型系统中不仅存在常见的A、B、AB、O四类,更存在着诸多亚型分支。2023年甘肃省血液中心在临床检测中发现的一例Aend亚型,因其血清学特征与常规抗-A反应微弱,最初被误判为O型,后经基因测序确认为新型A亚型变异体。这类案例揭示了血型亚型研究的临床价值,也引发公众对稀有血型认知的重新审视。
一、A亚型的生物学基础
A亚型的形成源于ABO基因位点的遗传变异。正常A型血的抗原合成依赖于α-1,3-N-乙酰半乳糖胺转移酶的活性,该酶由ABO基因的A等位基因编码。当基因发生突变导致酶活性部分缺失或结构改变时,红细胞表面A抗原的表达强度会显著降低,形成如A2、A3、Ax等不同亚型。以Aend亚型为例,其基因型表现为O1/A205杂合,A205等位基因的碱基突变使转移酶催化效率下降,仅能生成微量A抗原。
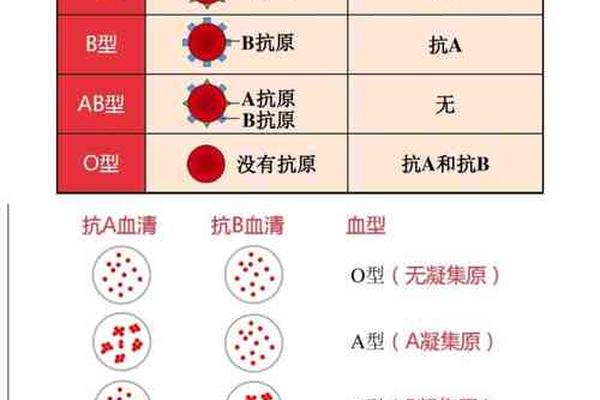
抗原表达的差异性直接影响血型鉴定。常规血清学检测依赖抗-A试剂与红细胞的凝集反应,但Aend亚型的抗原密度仅为正常A型的1/2000,在正定型试验中难以察觉。这种情况与孟买血型的H抗原缺失机制形成对比——后者因FUT1基因突变导致H前体物质合成障碍,进而影响ABO抗原的表达。
二、稀有性评估与流行病学
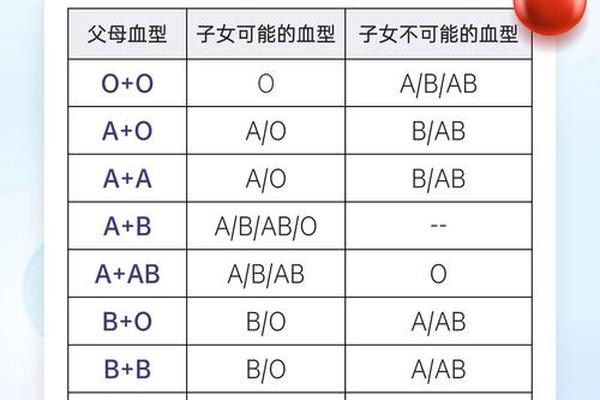
国际输血协会将人群分布率低于0.1%的血型定义为稀有型。Aend亚型在法国A型人群中的检出率为0.003%,远低于Rh阴性血型(中国汉族0.3%),更不及类孟买血型的十万分之一级稀有度。这种罕见性源于其特殊的遗传机制:A205等位基因需与O或B基因共显性才能表达,在随机婚配的遗传模式下,杂合携带者的子代仅有25%概率继承该基因。
全球范围内的A亚型分布呈现显著地域差异。研究显示,A2亚型在白种人中占A型群体的20%,而在亚洲人群中不足5%。更罕见的A亚型如Ael、Am等,多通过家系调查被发现。例如上海血液中心曾在三代直系亲属中追踪到Ax亚型的垂直传播,这种家族聚集现象提示特定基因变异可能在某些族群中持续存在。
三、临床检测的技术突破
传统血清学检测的局限性在A亚型鉴定中暴露无遗。Aend亚型的发现过程显示,其弱凝集特征需要采用增强试验——如木瓜酶处理红细胞或延长孵育时间——才能观察到混合视野凝集。分子生物学技术的介入彻底改变了检测范式,SSP-PCR可特异性扩增ABO基因的第6、7外显子,通过电泳条带判断等位基因型。二代测序技术更可精准定位SNP位点,如Aend亚型的c.467C>T突变即通过全基因测序确认。
质量控制体系对检测准确性至关重要。全国血型参比实验室采用三级复核制度:初筛实验室发现异常样本后,需经省级实验室血清学复核,最终由国家实验室进行基因测序确认。这种多层级验证机制将误判率控制在10^-6以下,确保输血安全。
四、输血医学的实践挑战
A亚型误判可能引发严重临床后果。若将Aend型血液误作O型输给O型受血者,供者血浆中的弱抗-A可能攻击受者红细胞。反之,若Aend型患者被误判为O型,输入O型血时可能因受者体内的抗-A引起溶血反应。这要求血库建立稀有血型冷冻保存系统,甘肃省血液中心采用-80℃深低温保存技术,使红细胞存活期延长至10年。

特殊血型个体的健康管理需要个性化方案。建议A亚型携带者定期进行抗体筛查,妊娠女性需在孕16周前完成不规则抗体检测。基因检测技术的普及使婚前ABO基因筛查成为可能,上海等地已开展试点项目,通过基因分型预测新生儿溶血风险。
五、未来研究方向
群体遗传学研究亟待深入。建立中国人群ABO等位基因数据库,有助于揭示A亚型的地域分布规律。日本学者发现Langereis血型与辐射暴露存在关联,这提示环境因素可能影响血型变异,相关机制值得探索。
基因编辑技术为治疗提供新思路。CRISPR-Cas9技术已成功修复β-地中海贫血患者的HBB基因,类似方法或可应用于ABO基因修饰。合成生物学领域,人工培育通用型O型红细胞的研究取得突破,2024年英国团队利用iPSC技术实现O型红细胞的规模化生产,这为稀有血型替代治疗开辟新路径。
血型系统的复杂性既是生命进化的见证,也是医学研究的富矿。Aend亚型的发现不仅完善了人类对ABO系统的认知,更警示我们:在精准医学时代,血型鉴定必须跨越血清学的局限,走向分子水平的深度解析。未来需要建立全国联动的稀有血型网络,整合基因数据库与冷冻库存,让每个特殊血型个体都能获得生命保障。正如国际输血协会倡导的,血型研究的终极目标,是让"稀有"不再意味着"危险",而是转化为可预测、可管理的医学常态。