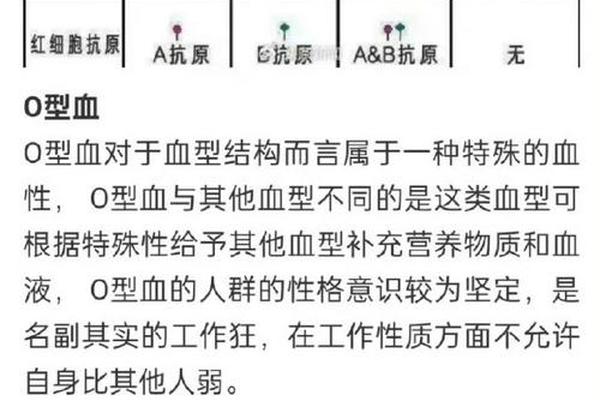
Rh血型系统是人类红细胞表面复杂的抗原体系,其核心抗原D的缺失定义为Rh阴性血型(俗称"熊猫血"),在中国汉族人群中仅占0.3%-1%。当A型Rh阴性孕妇怀有Rh阳性胎儿时,母体可能因胎儿红细胞通过胎盘屏障进入血液循环而产生抗D抗体。这一过程称为致敏,主要发生在分娩、流产或医源性操作(如羊膜穿刺)中。
值得注意的是,首次妊娠时母体免疫系统尚未完全激活,抗D抗体以IgM为主,无法通过胎盘屏障。但再次妊娠时,IgG类抗体会迅速穿越胎盘攻击胎儿红细胞,导致溶血性贫血、高胆红素血症甚至胎儿水肿。这种"记忆性免疫应答"解释了为何Rh阴性孕妇初次妊娠风险较低,但后续妊娠风险显著增加的特殊现象。
二、孕期监测与抗体筛查策略
对于A型Rh阴性孕妇,系统化的产前监测体系至关重要。建议从妊娠16周开始每4周进行抗体效价检测,采用抗人球蛋白试验(Coombs试验)和流式细胞术双重验证。当抗体效价≥1:64时,需启动胎儿大脑中动脉收缩期峰值流速(MCA-PSV)监测,该指标能敏感反映胎儿贫血程度,准确率达85%以上。
在临床实践中,羊水ΔOD450光谱分析仍是评估胎儿溶血严重程度的金标准。但近年来无创产前检测(NIPT)技术突破显著,通过检测母血中游离胎儿DNA的RHD基因,可提前12周明确胎儿Rh状态,避免侵入性操作风险。对于已致敏孕妇,建议每2周进行胎儿超声生物物理评分,结合脐静脉血流动力学参数动态评估胎儿预后。

三、Rh免疫球蛋白的临床应用与争议
抗D免疫球蛋白的规范化使用可将Rh同种免疫发生率从16%降至0.1%。国际指南推荐在孕28周常规注射300μg,产后72小时内追加剂量。特殊情况下如羊膜穿刺后需即时补充100μg,而重大创伤事件后应按每30ml胎儿血输入300μg的标准追加。但剂量标准存在地域差异,澳大利亚采用28周和34周双剂125μg方案,其理论依据是维持母体被动免疫的抗体滴度。
争议焦点集中在早孕期预防的适用性。WHO最新指南建议孕12周前仅对手术流产者进行预防,而ACOG则主张覆盖所有早期妊娠丢失。我国学者研究发现,孕8周自然流产后母体FMH(胎母输血)量中位数仅0.2ml,支持选择性预防策略。重组抗D单克隆抗体(如ROSULID)的Ⅲ期临床试验显示,其半衰期较血浆源性产品延长3倍,可能成为未来预防新选择。
四、母胎干预技术与围产期管理
当胎儿出现严重贫血(MCA-PSV>1.5MoM)时,宫内输血成为关键救治手段。采用O型Rh阴性辐照浓缩红细胞,通过脐静脉穿刺直接输入胎儿腹腔,32周前每次输注量控制在100ml以内。新型超声引导下肝内静脉输血技术可将并发症发生率从12%降至3.8%。
对于孕32周后的重度溶血胎儿,多学科团队需权衡早产风险与继续妊娠利弊。新生儿出生后应立即进行换血治疗,换血量按150-180ml/kg计算,同时监测血清胆红素每小时上升速度。值得注意的是,Rh阴性孕妇需在预产期前1个月完成自体储血,三级医院应常规储备冰冻Rh阴性红细胞。
A型Rh阴性孕妇的妊娠管理体现了精准医学在围产领域的深度应用。通过建立"孕前咨询-孕期监测-靶向干预"三级预防体系,可将胎儿死亡率控制在5%以下。未来研究方向应聚焦于基因编辑技术修复RhD基因缺陷、开发长效重组抗D制剂,以及建立区域性熊猫血孕妇动态数据库。建议卫生行政部门将Rh血型筛查纳入孕前常规检查项目,并通过多中心研究制定符合中国人群特征的防治指南,为稀有血型群体构建全周期健康保障体系。