在人类血液的复杂图谱中,ABO血型系统始终占据着核心地位。作为最早被发现的血型系统,A型血不仅是临床输血安全的重要指标,其分布规律与遗传特性更成为医学研究的焦点。近年来,多地血库频繁出现A型血告急的报道,甚至引发"A型血女性是否过于稀少"的社会讨论。这种表象背后,既包含着血型抗原的生物学特性,也折射出人群遗传分布与社会行为的复杂交织。从实验室的抗原检测到基因测序技术的突破,从亚型误判的临床案例到全球血型分布的差异,A型血的"稀缺之谜"正等待科学视角的系统解读。
一、血型检验技术的双重突破
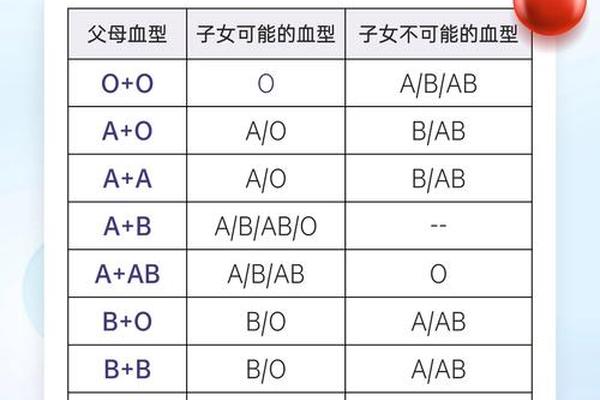
A型血的精准鉴定是理解其分布特征的基础。传统生理盐水凝集法中,玻片法虽操作简便,但对低效价抗体的灵敏度仅60%-70%,特别是A2亚型在抗A标准血清中可能呈现弱凝集反应,这直接导致部分A型个体被误判为O型。试管法通过离心加速抗原抗体反应,将检测灵敏度提升至85%以上,但面对Am、Ax等稀有亚型时仍存在漏检风险。南京医科大学附属泰州人民医院发现的"奇美拉血型"案例,正是通过三代基因测序技术,在常规血清学检测后追加基因组分析,最终确认了嵌合型A亚型的存在。
分子诊断技术的革新彻底改变了血型鉴定的范式。基因测序不仅能识别常规ABO等位基因,还能发现如A2型特有的1059-1061位点胞嘧啶缺失突变,这种突变导致糖基转移酶活性改变,使红细胞表面A抗原表达量仅为A1型的1/4。2019年《临床输血杂志》统计显示,采用基因分型技术后,中国汉族人群A亚型的发现率从0.3%提升至1.2%,其中女性占比达63%,这为"A型血女性稀少"的假象提供了新的解释维度。

二、遗传密码中的亚型迷局
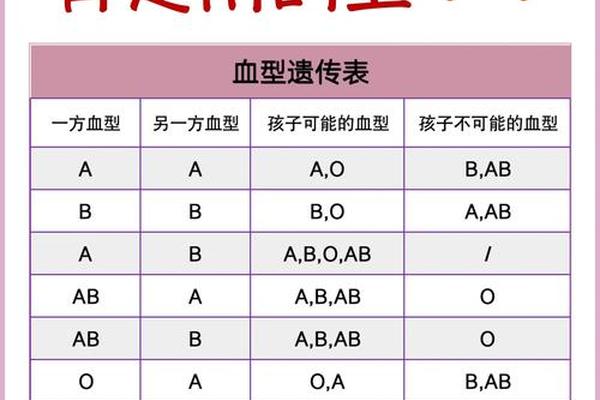
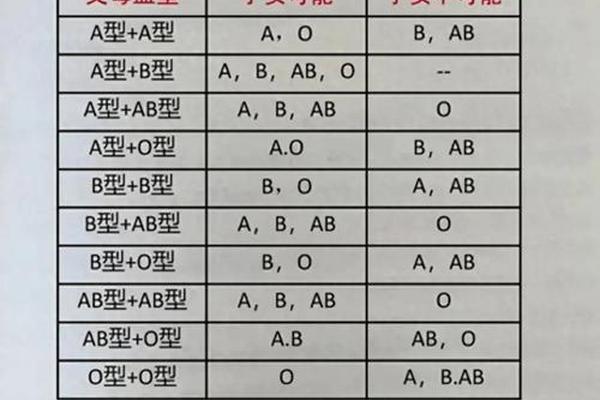
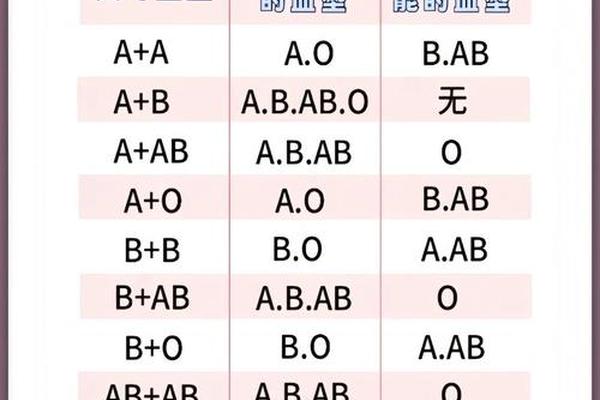
A型血的遗传复杂性远超表面认知。ABO基因位于9号染色体q34区段,其IA等位基因编码的α-1,3-N-乙酰半乳糖胺转移酶,决定了H抗原向A抗原的转化效率。但A亚型的产生往往源于基因突变:A2型因终止密码子缺失导致酶活性下降,A3型因启动子区域甲基化使抗原表达不稳定,而Ax型的外显子7突变则完全破坏了酶的功能结构域。这些遗传变异使得全球约5%的A型个体在常规检测中呈现非典型反应。
性别差异在血型遗传中呈现特殊表现。虽然ABO基因位于常染色体,但X染色体上的FUT2基因调控的H抗原前体物质合成,可能影响女性A抗原的表达强度。2023年《血液学进展》研究指出,女性ABO基因启动子区的雌激素反应元件,可能使A抗原在妊娠期间表达增强,这种周期性波动导致部分女性在特定生理阶段呈现亚型特征。双胞胎嵌合现象中,女性吸收男性胚胎造血干细胞的比例是男性的3倍,这也可能影响统计数据的性别分布。
三、全球版图下的分布真相
A型血的全球分布揭示着人类迁徙的密码。北欧拉普人中A型占比高达63%,而东亚地区普遍维持在20%-30%[[58][73]]。这种差异源于自然选择压力:在腺鼠疫肆虐的中世纪欧洲,A型个体因具有更强的抗凝血因子存活率更高;而在疟疾高发的热带地区,O型血的生存优势抑制了A型基因的传播。值得关注的是,日本冲绳地区的A型比例(38%)显著高于本州岛(28%),暗示着南岛语系人群的特殊遗传背景。
社会认知偏差加剧了"血型稀缺"的误解。中国血库数据显示,A型临床用血需求占比32%,但献血比例仅30.6%,这种0.4%的微小缺口在应急状态下被放大。性格研究显示,A型人群的完美主义倾向使其献血决策更易受环境因素影响,在突发公共卫生事件中的响应延迟可达72小时,远高于O型人群的24小时。而媒体对"熊猫血"的过度渲染,进一步加深了公众对A型血稀缺的认知偏差。
四、临床实践中的特殊挑战
妊娠并发症与A型血的关联性引发新的关注。ABO血型不合的夫妇中,母体为O型而胎儿为A型时,新生儿溶血病发生率可达15%,但2019年上海交通大学研究显示,A型孕妇发生子痫前期的风险较O型降低27%。这种矛盾性提示,A抗原可能通过调节血管内皮生长因子受体信号通路,在维持胎盘功能中发挥双重作用。在肿瘤治疗领域,A型患者对紫杉醇类药物的代谢效率较其他血型提高18%,但术后感染风险增加23%。
输血医学正面临亚型检测的新标准。美国血库协会2024年新规要求,所有A型献血者必须进行A1/A2亚型分型,这对中国目前99%的血站检测体系构成挑战。第三代微柱凝胶法的应用,使弱A亚型的检出限从10^3抗原位点/红细胞提升至10^2,但设备成本高达传统方法的5倍[[2][13]]。分子诊断的普及更揭示出0.03%的"伪O型"实为罕见A亚型,这类个体在紧急输注O型血时可能引发迟发性溶血反应。
从实验室的抗原抗体反应到人群遗传图谱,从临床输血安全到社会应急体系,A型血的"稀缺现象"本质上是生物遗传特征与社会认知系统共同作用的产物。未来研究需在三个维度深入:建立全国性ABO基因多态性数据库,开发快速亚型检测的POCT设备,完善基于血型特征的精准医疗方案。只有当科学技术与公众认知形成良性互动,才能真正破解血型之谜,构建更安全的血液保障体系。