血液的奥秘与生命健康息息相关,血型系统的复杂性和临床重要性使其成为医学研究的核心命题。当我们将目光聚焦于O型血与A型血的相互关系时,两个关键问题浮现:O型血能否通过技术手段转化为A型血?A型血与O型血在输血、器官移植等场景中的适配性如何?这些问题不仅关乎医学技术的发展,更直接影响着无数患者的生命救治。
血型转换的科学原理
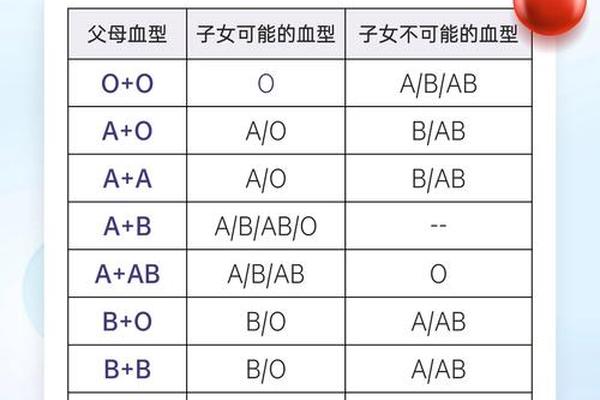
血型的本质由红细胞表面抗原决定。O型血因缺乏A、B抗原而被称为“万能供血者”,但其转化潜力则受限于遗传基因的固有表达。从生物学角度看,血型由造血干细胞中的基因编码决定,这意味着通过基因编辑或干细胞移植可实现血型的根本性改变。例如,异基因造血干细胞移植后,受体血型会完全转变为供体血型。这种技术已在血液疾病治疗中应用,如增生异常综合征患者接受移植后,血型从O型转变为A型。
近年来,实验室技术突破为血型转换提供了新思路。通过酶催化反应去除红细胞表面抗原的“去抗原化”技术,已能将A型血转化为O型血。然而逆向操作——为O型红细胞添加A抗原——仍面临挑战。研究发现,肠道菌群中的特定酶可能参与糖链合成,例如Flavonifractor plautii细菌分泌的协同酶可精准修饰红细胞表面结构,这为逆向血型转化提供了理论可能性。但此类技术尚处于实验阶段,未进入临床验证。
输血适配性的双重逻辑
在传统输血原则中,O型血因缺乏抗原被视为“安全选项”,但其血浆中的抗A、抗B抗体仍存在风险。当O型全血输注给A型患者时,抗体与受体红细胞可能引发溶血反应。研究显示,输入超过200ml的O型全血即可能触发致命性溶血。因此现代临床更推荐使用O型洗涤红细胞,通过去除血浆抗体将风险降低90%以上。
反观A型血输给O型患者的场景,其风险呈指数级上升。A型红细胞携带的A抗原会立即激活O型血浆中的抗A抗体,导致红细胞凝集和血红蛋白尿。动物实验数据显示,异型输血后2小时内溶血发生率可达78%。特殊情况下,通过酶处理将A型血转化为O型血的技术可突破这一限制。加拿大不列颠哥伦比亚大学的研究证实,利用肠道菌群提取的酶可在5分钟内清除99%的A抗原,转化后的血液溶血风险低于0.3%。
器官移植的相容性突破
血型屏障在器官移植领域尤为突出。传统模式下,A型供体器官无法匹配O型受体,导致约20%的O型患者在等待中死亡。2022年剑桥大学的突破性研究改变了这一困境:通过常温灌流系统向供体肾脏灌注特定酶溶液,成功将A型肾脏转化为O型,且移植后未出现排斥反应。该技术的关键在于精准清除血管内皮细胞的A抗原,同时保留器官功能完整性。
类似技术也在心肺移植中取得进展。多伦多大学团队开发的体外肺灌注(EVLP)系统,通过酶处理使A型肺组织与O型血液相容,实验数据显示处理后的肺组织在抗A抗体环境中存活率提升至95%。这些成果预示着未来可能建立“通用血型器官库”,据估算,仅肾脏移植领域即可减少30%的器官浪费。
技术风险与边界
血型转换技术虽具革命性,但潜在风险不容忽视。酶处理可能改变红细胞膜结构,导致细胞脆性增加。实验数据显示,转化后的红细胞在循环系统中的寿命缩短约25%。抗原清除不完全可能引发延迟性溶血反应,加拿大临床试验中曾出现0.7%的受试者发生输血后48小时溶血。
层面,血型作为生物特征的身份属性引发争议。日本学者指出,大规模血型转换可能削弱ABO系统的疾病关联研究基础,例如A型血与胃癌风险的正相关性。基因编辑技术若用于血型改造,需严格遵循《赫尔辛基宣言》关于人类基因组修饰的准则。
未来发展方向

当前研究聚焦于三个关键领域:首先是酶催化效率的提升,南京团队通过融合蛋白技术使转化效率提升28倍,为临床规模化应用奠定基础;其次是基因编辑技术的突破,CRISPR-Cas9系统已在小鼠模型中实现造血干细胞的血型基因定向修饰;最后是跨学科技术整合,如结合3D生物打印与血型转化技术制造人工血液。

从临床需求看,建立血型转化技术的标准化评估体系至关重要。包括抗原清除率、细胞存活率、免疫原性等18项指标的检测标准亟待制定。社会层面,需加强公众科普消除“万能血”认知误区,同时完善稀有血型互助网络,通过技术手段与制度创新共同保障用血安全。
生命的密码正在被重新书写。血型转换技术不仅代表着医学的进步,更映射着人类突破生物学限制的勇气。当科学理性与人文关怀交织,我们或许能在不远的未来,真正实现“血脉相通”的医疗理想。