当生命在母体中孕育,血型作为基因的无声语言,悄然编织着两代人的生物学纽带。对于A型Rh阴性血型的母亲而言,这种纽带不仅涉及ABO系统的复杂组合,更与罕见的Rh因子密切关联。从基因重组到免疫风险,从常规遗传到医学干预,这条遗传链的每个环节都蕴含着现代医学对生命密码的深刻解读。
ABO与Rh双系统的遗传逻辑
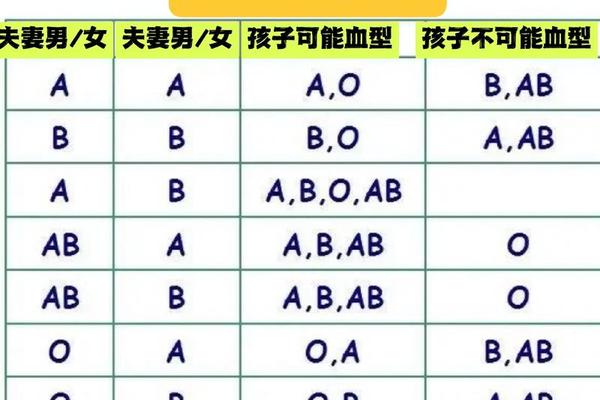
在ABO血型系统中,A型血父母的基因组合可能是AA或AO。若母亲为AO型(隐性携带O基因),父亲为O型时,子女可能为A型(50%)或O型(50%);若父亲为B型,则子女可能涵盖A、B、AB、O四种血型。这源于A、B为显性基因,O为隐性基因的遗传特性。例如父亲为AB型时,子女将继承A或B基因,与母亲的A基因组合形成AA、AB、AO等类型,因此子女可能为A型(50%)、B型(25%)或AB型(25%),但绝不可能是O型。
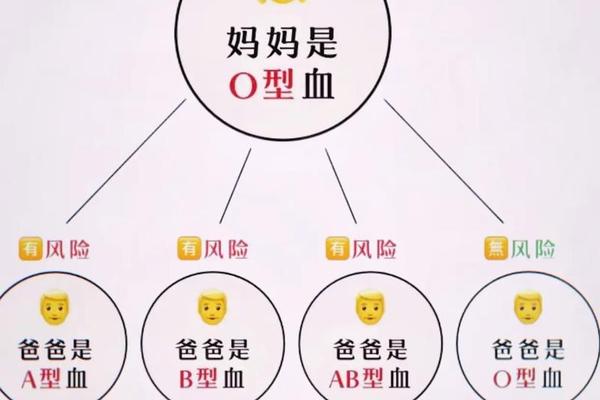
Rh系统的遗传则更为简明:Rh阴性(Rh-)属于隐性遗传。若母亲为Rh-,父亲为Rh+(基因型为DD或Dd),子女有50%概率继承D基因成为Rh+;若父亲同为Rh-(dd),子女必然为Rh-。这种“阴性屏障”使得Rh-母亲与Rh+父亲的组合在二胎时可能引发免疫攻击,成为医学监测的重点。

新生儿溶血的潜在风险与防御
Rh血型不合引发的溶血风险具有累积性。首次妊娠时,胎儿Rh+红细胞可能通过胎盘进入母体,刺激母体产生抗D抗体。这些IgG抗体在二次妊娠时穿越胎盘,攻击胎儿红细胞,导致溶血性贫血、肝脾肿大甚至胎儿水肿。数据显示,未进行干预的Rh-母亲二胎溶血发生率可达17%,三胎时升至50%。

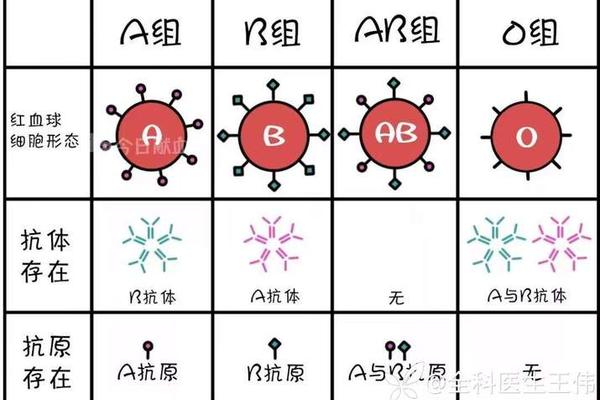
ABO系统的溶血风险则相对温和。当母亲为O型(携带抗A、抗B抗体)而胎儿为A/B型时,母体的IgM抗体因分子量较大难以通过胎盘,因此仅4%的ABO不合案例会出现临床症状,且多表现为出生后黄疸。值得注意的是,A型Rh-母亲若同时存在ABO不合(如胎儿为B型),两种系统的免疫反应可能产生叠加效应,需通过抗体效价检测进行动态评估。
医学干预的三重防护体系
预防性注射抗D免疫球蛋白已成为Rh-母亲的标准护理。在孕28周进行首次注射可中和胎儿泄漏的D抗原,分娩后72小时内追加注射能将二胎溶血风险从15%降至1%。对于已致敏的高危孕妇,胎儿宫内输血技术可将存活率提升至85%以上,但需在具备新生儿重症监护条件的医院实施。
基因检测技术的进步为精准干预提供了新路径。通过孕妇外周血中的胎儿游离DNA(cffDNA),孕早期即可无创判断胎儿Rh血型,避免不必要的抗体监测。对于罕见的“顺式AB”或“孟买血型”等特殊情况,基因测序能有效识别隐性基因突变,修正传统血型检测的误差。
超越常规的遗传特例
约0.01%的亚洲人群携带孟买血型(伪O型),其红细胞缺乏H抗原,导致常规检测显示为O型,但实际携带A/B基因。这类母亲若与A/B型父亲结合,可能诞下A/B型子女,与经典遗传表型产生矛盾。另一种罕见情况是顺式AB基因,即单个等位基因同时控制A、B抗原合成,使得AB型与O型父母可能生育AB型后代。
基因重组现象同样值得关注。2023年研究发现,X染色体上的PIGG基因突变可能影响ABO抗原表达,导致血型嵌合现象。这类案例提示,传统血型对照表需结合分子诊断技术才能实现精准判断。
生命密码的启示与展望
血型遗传规律既是生命科学的基础课题,也是临床医学的实践指南。对于A型Rh阴性母亲而言,科学的孕前咨询、动态的抗体监测以及及时的医学干预,能有效化解遗传风险。未来研究需进一步探索表观遗传对血型表达的影响,开发更灵敏的早期筛查技术,同时完善罕见血型数据库,为精准医疗提供支撑。生命的传承从来不是简单的基因复制,而是在分子对话中书写新的可能——这或许正是血型遗传给予人类最深刻的启示。