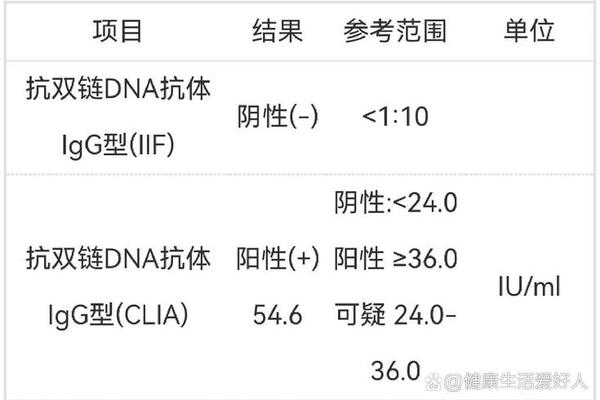
在临床免疫学与分子诊断领域,抗双链DNA抗体IgG型(CLIA法)的检测已成为系统性红斑狼疮(SLE)等自身免疫性疾病诊疗的核心指标之一。其独特的生物学特性与致病机制,使其不仅是SLE诊断的重要标志物,更与疾病活动度、器官损伤及治疗反应密切相关。随着化学发光免疫分析(CLIA)技术的普及,该抗体的检测灵敏度和特异性显著提升,为精准医疗提供了新的技术支撑。本文将从生物学特性、检测技术、临床意义及研究进展等多维度展开探讨。
一、生物学特性与致病机制
抗双链DNA抗体IgG型属于抗核抗体家族,其靶向抗原为双链DNA(dsDNA)的脱氧核糖磷酸骨架。研究表明,该抗体主要通过两种途径引发组织损伤:一是与循环中的游离DNA形成免疫复合物,沉积于肾脏、皮肤等器官微血管结构,激活补体系统并诱发炎症反应;二是直接穿透活细胞(如肾小球膜细胞),干扰细胞功能并诱导凋亡。
致病性抗双链DNA抗体IgG型具有高亲和力、补体结合能力及多反应性特征。例如,其可通过静电引力与基底膜上的硫酸乙酰肝素、层粘连蛋白等非DNA抗原交叉反应,导致肾小球基底膜损伤。近年研究还发现,该抗体能促进B细胞异常活化,形成自身免疫的正反馈环路,进一步加剧疾病进展。
二、检测技术的革新与CLIA优势
传统检测方法如间接免疫荧光法(IIF)和酶联免疫吸附法(ELISA)虽广泛应用,但存在灵敏度受限或假阳性率高等问题。IIF法以绿蝇短膜虫动基体为抗原,特异性可达95%,但无法检测低亲和力抗体;ELISA法虽能定量分析,但受ssDNA污染影响可能产生6%的假阳性。
化学发光免疫分析(CLIA)技术的引入显著优化了检测效能。通过标记DNA抗原与抗体结合后产生的光信号,CLIA实现了高灵敏度(可检测低至1 IU/mL的抗体水平)与高特异性(天然dsDNA抗原减少交叉反应)。优品生物等开发的试剂盒显示,CLIA的批间变异系数小于5%,且可兼容血清、血浆等多种样本类型。相较于放射免疫法,CLIA还避免了放射性污染风险,更适合临床常规检测。
三、临床意义的多维关联
在SLE诊断中,抗双链DNA抗体IgG型的特异性达90%,阳性率随疾病活动度波动(活动期80%-100%,缓解期低于30%)。其水平升高常提示肾脏受累(狼疮性肾炎)或皮肤病变(颊部红斑),与补体C3/C4降低、抗核小体抗体阳性呈显著正相关。动态监测发现,抗体滴度早于临床症状复发6-8周出现,为早期干预提供了窗口期。
值得注意的是,该抗体并非SLE专属。约5%-10%的干燥综合征、类风湿关节炎患者呈现低滴度阳性,需结合抗Sm抗体等其他标志物鉴别诊断。感染或药物诱导的自身免疫反应也可能导致短暂性抗体升高,需通过多时间点检测排除干扰。
四、研究进展与未来挑战
近年研究聚焦于抗双链DNA抗体IgG型的异质性及其与特定临床表型的关联。例如,IgG3亚型因强补体激活能力,与重症狼疮肾炎的相关性显著高于其他亚型;而IgG1亚型则更常见于皮肤黏膜病变。单细胞测序技术进一步揭示了抗体产生的B细胞克隆扩增特征,为靶向治疗提供了新思路。
未来方向包括:①开发基于表位特异性检测的试剂盒,区分致病性与非致病性抗体;②探索抗体水平与基因组不稳定性的关联,如在端粒酶缺陷疾病中的作用;③建立多模态监测体系,整合抗体动态变化、细胞因子谱及影像学数据,实现个体化治疗。
抗双链DNA抗体IgG型(CLIA法)的检测革新,不仅提升了SLE的诊断精度,更深化了对其病理机制的认知。随着对抗体异质性和致病通路的解析,未来有望实现从“疾病标志物检测”到“精准免疫调控”的跨越。建议临床实践中结合多种检测方法互补验证,并开展抗体亚型分析与功能研究,从而为分层治疗、预后评估提供更全面的生物学依据。