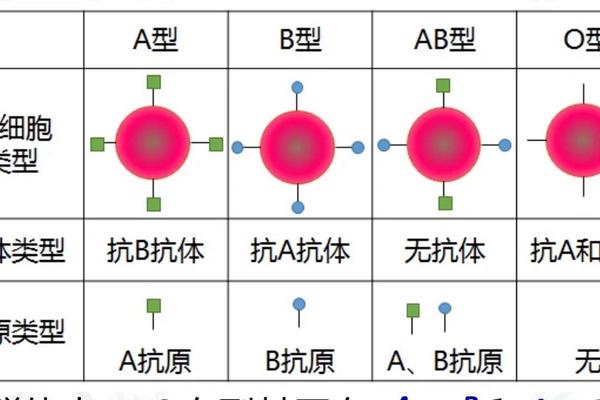
在传统器官移植领域,ABO血型系统曾是不可逾越的屏障。根据输血原则,AB型受体因红细胞同时携带A、B抗原且血清无抗A、抗B抗体,理论上可接受任何血型的器官。但实践中发现,当AB型患者接受A型供肾时,供肾的A抗原会与受体免疫系统发生复杂反应。近年研究显示,通过血浆置换清除血型抗体(如抗A效价降低至1:4以下)并配合免疫抑制剂,可实现跨血型移植。例如2020年华中科技大学同济医院成功完成AB型供体向O型受体的肾移植,证实了该技术的可行性。
这种突破性技术的核心在于免疫调控。术前通过血浆置换、免疫吸附或静脉注射免疫球蛋白等方法清除受体体内预存抗体;术中采用抗CD20单克隆抗体抑制B细胞活性;术后维持他克莫司+霉酚酸酯+糖皮质激素的三联免疫抑制方案。数据显示,经过上述处理的ABO血型不合肾移植术后1年存活率达85%-90%,与血型相容移植的差距已显著缩小。但该技术仍面临术后感染风险增高(约30%患者出现细菌或病毒感染)、治疗费用昂贵(人均增加15-20万元)等挑战,需严格筛选适应证人群。
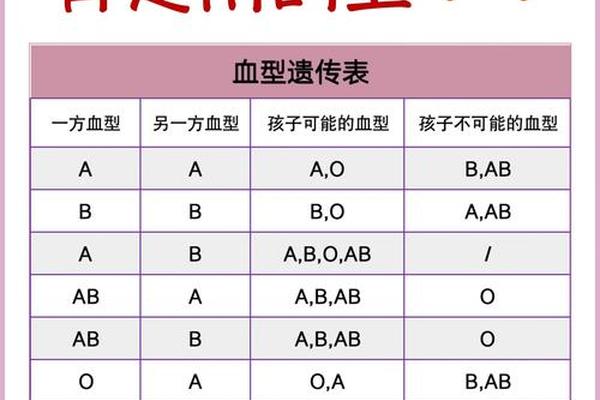
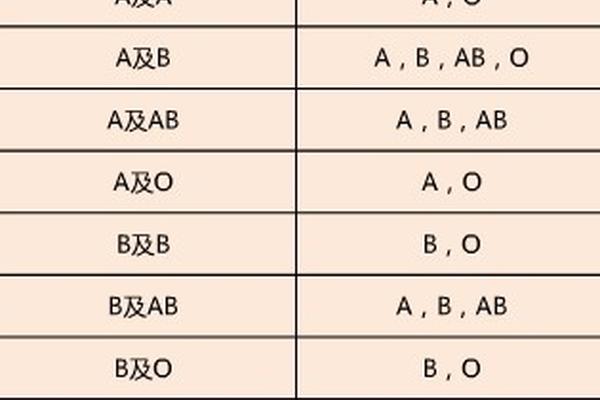
二、B型血父母生育AB型儿的遗传学解析
从经典孟德尔遗传规律来看,父母均为B型血时,子女血型应为B型(概率75%)或O型(概率25%)。这是因为B型血的基因型为BB或BO,父母双方只能传递B或O基因。但2015年韩国三星首尔医院发现的Cis-AB09血型案例彻底颠覆了这一认知。该案例中B型父母通过基因突变,将原本独立的A、B抗原编码基因融合于同一条染色体,形成罕见的顺式AB遗传模式,最终诞下AB型后代。
这种遗传异常的发生机制涉及ABO基因座的特殊重组。正常情况下,A和B等位基因分别位于两条9号染色体,而顺式AB突变使单个染色体同时携带A、B抗原决定簇。日本学者山本的研究表明,此类突变多发生于ABO基因第7外显子,导致糖基转移酶具有双重催化功能,既能合成A抗原的N-乙酰半乳糖胺,又能合成B抗原的半乳糖。全球数据库显示,顺式AB血型出现概率低于百万分之一,我国目前仅报道过8例,且多集中于华东地区。
三、血型认知革新对医学实践的启示
ABO血型系统的复杂性要求临床工作者更新认知框架。在器官移植领域,英国剑桥大学2022年研发的酶处理技术,通过α-N-乙酰半乳糖胺酶去除供肾A抗原,成功将A型肾转化为通用O型。这种体外血型改造技术使跨血型移植不再依赖血浆置换,可将器官利用率提升40%,特别有利于少数民族等血型特殊人群获得移植机会。多伦多大学王爱周团队更在此基础上开发出FpGalNAc脱乙酰酶,实现肺脏血型的体外转换。
在遗传诊断方面,建议对血型异常家庭进行ABO基因测序。采用PCR-SSP法可检测顺式AB、孟买型等罕见血型,避免亲子关系误判。上海瑞金医院建立的ABO基因分型数据库显示,约0.03%的"违反"遗传规律案例实为特殊血型变异,需结合血清学与分子检测综合判断。
血型系统的生物学特性正在医学技术进步中重新定义。ABO不相容器官移植通过免疫调节创造生命奇迹,基因突变揭示的人类遗传多样性则推动着精准医学发展。未来研究方向应聚焦于:开发更安全的血型转换酶制剂、建立罕见血型干细胞库、探索CRISPR基因编辑在血型改造中的应用。正如诺贝尔奖得主兰德施泰纳所言:"血液的密码永远比我们想象的更深邃",这些探索将不断拓展生命科学的疆界。