在人类ABO血型系统中,B(A)血型是一种极为罕见的亚型,其全球分布频率约为0.3-1.6人/10万,在中国人群中约为1/5万-1/10万。这种血型在常规检测中常被误判为AB型,但其独特的遗传机制和分子特征使其成为医学界关注的焦点。它不仅挑战了传统血型遗传规律,更因其输血配型的复杂性影响着临床安全,其稀有性背后是基因突变、检测技术限制与群体遗传特征共同作用的结果。
遗传机制的独特性
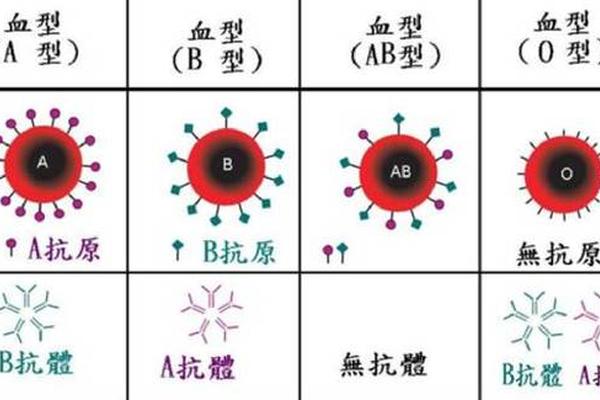
B(A)血型的核心成因在于B基因的突变。正常B型血由B等位基因控制,而B(A)型则是B基因外显子6或7发生错义突变,导致其编码的糖基转移酶获得微弱合成A抗原的能力。这种突变使红细胞表面呈现强B抗原与弱A抗原共存的现象,但A抗原的三维结构与正常A型存在差异,仅能被部分单克隆抗-A试剂识别。例如在重庆发现的病例中,患者红细胞与抗-B试剂反应强度达4+,而与抗-A试剂的凝集反应强度因厂商不同呈现显著波动。
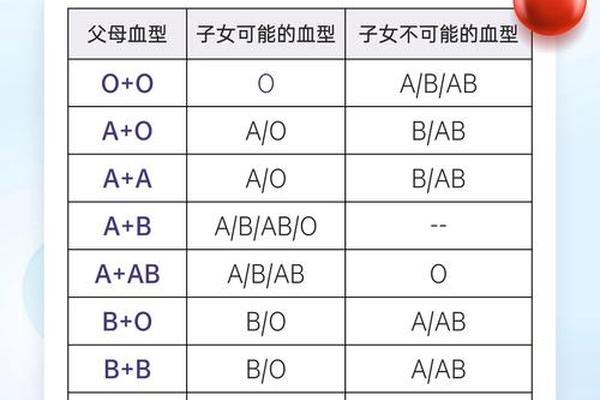
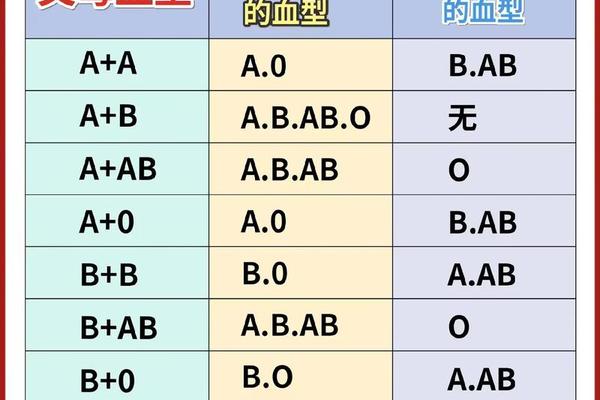
这种突变基因的遗传表现为显性特征。当B(A)基因与O型基因组合时,子代可能呈现B(A)或O型;若与B型基因组合,则可能出现B(A)/B基因型。由于血型表现不符合常规遗传规律(如B型父母可能生出AB型子女),极易引发家庭信任危机。江西曾报道的案例显示,B(A)型父亲与O型母亲生育的子女血型呈AB型,造成亲子关系误解,这种遗传特殊性加剧了该血型的社会认知障碍。
检测技术的局限性
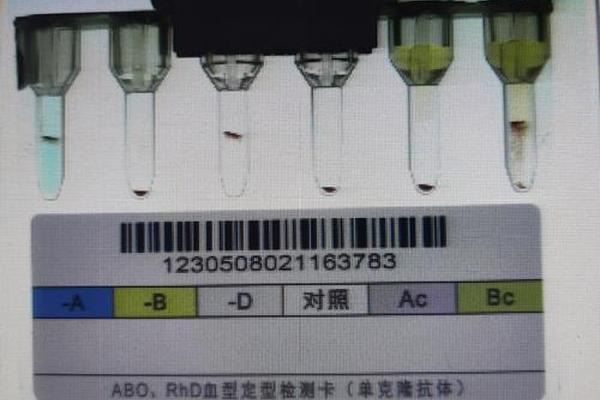
血清学检测的复杂性是导致B(A)型识别率低的关键因素。其血清反应格局呈现正定型(红细胞抗原检测)与反定型(血清抗体检测)不符的特征:正定型显示AB型特征,而反定型血清中却存在抗-A抗体。这与正常AB型血清中无抗-A/抗-B抗体的特性形成矛盾。更复杂的是,不同厂商的单克隆抗-A试剂对弱A抗原的识别存在差异,部分试剂甚至完全不反应,这种检测结果的不确定性使基层医疗机构常将其归类为AB型。
分子生物学检测虽能精准鉴定,但实施门槛较高。重庆案例中,通过基因测序发现患者携带ABOBA.04/ABOO.01.02复合突变,这种检测需特定设备和专业人员。我国自2004年才开展血型基因检测,截至2023年全国仅少数三甲医院具备检测能力。技术限制导致大量B(A)型个体被漏检,浙江某医院曾发现患者多次检测结果在O型与B型间跳变,最终基因检测确认为B(A)型,凸显检测标准化的迫切需求。
群体分布的特殊性
B(A)血型的分布呈现显著地域差异。欧洲白种人群的发病率约1/17万-1/58万,而中国人群达1/5万-1/10万,这种差异可能与基因多态性相关。目前已发现的6种B(A)等位基因中,中国人群以B(A)02、B(A)04、B(A)05和B(A)06为主,提示亚洲人群可能存在特定的突变热点区域。但当前我国缺乏全国性流行病学调查,实际发病率可能被低估,江西和重庆的个案发现均属偶然,系统性筛查的缺失使数据可靠性存疑。
临床安全的挑战性
在输血医学领域,B(A)血型被列为高风险类型。其血清中含强效抗-A抗体,若误输注AB型血液可能引发溶血反应。重庆病例中,医院最终选择B型洗涤红细胞进行输注,这种处理方式虽安全却增加医疗成本。更严峻的是,约30%的B(A)型个体存在其他稀有血型抗原缺失,形成复合稀有血型,进一步加剧配血难度。建立B(A)型专属血库迫在眉睫,但目前全球尚未形成有效的资源共享机制。
B(A)血型的稀有性本质上是基因突变、检测盲区与群体遗传特征共同塑造的结果。其发现历程揭示出血型系统的复杂性:从孟买血型到顺式AB型,人类已发现35种血型系统,每种系统都可能存在类似B(A)型的特殊变异。未来研究需在三个方向突破:开发高灵敏度血清学检测试剂盒,建立全国性稀有血型基因数据库,加强公众对血型遗传特殊性的认知。只有通过技术创新与知识普及的双重努力,才能保障B(A)型等稀有血型群体的医疗安全,避免因血型误解引发的社会问题。