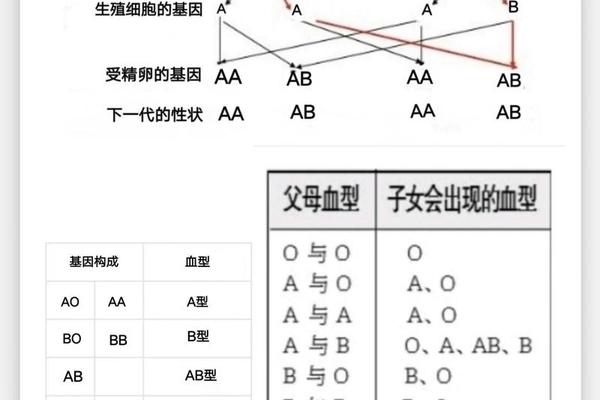
在医学界,血型长期被视为与指纹同等稳定的生物标识。然而2025年河北某医院收治的烧伤患者案例,却颠覆了这一传统认知——该患者治疗期间血型从AB型转变为A型,引发临床输血异常。这种被称为"血型变异"的现象,不仅涉及免疫学与遗传学的深度交叉,更对临床输血安全、器官移植等领域带来重大挑战。当基因的稳定性遭遇生命系统的复杂调控,血型变化的背后究竟隐藏着怎样的生物学密码?

医学机制的多重维度
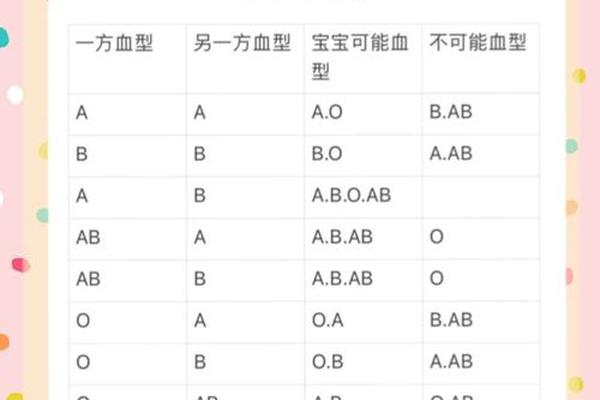
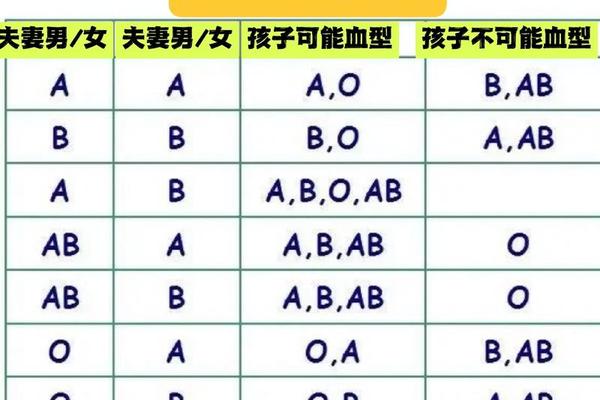
血型改变的医学基础源于红细胞表面抗原的动态表达。在ABO血型系统中,AB型红细胞同时携带A、B两种抗原,其变异为A型意味着B抗原的消失或遮蔽。这种变化可能由造血干细胞移植引发,如网页50记录的移植案例中,供体O型干细胞成功取代受体原有造血系统,导致受体血型完全转变。这种改变本质上是供体造血系统取代受体,而非基因层面的突变。
疾病状态下的抗原表达异常是另一重要机制。网页12详述的烧伤案例中,患者因严重创伤导致免疫系统紊乱,B抗原表达减弱至检测阈值以下。类似现象在白血病患者中更为常见,如网页16指出恶性肿瘤细胞会干扰糖基转移酶活性,使红细胞无法正常合成B抗原。这种"表观血型变异"并不改变DNA序列,但足以造成临床检测的误判。
遗传密码的复杂解码
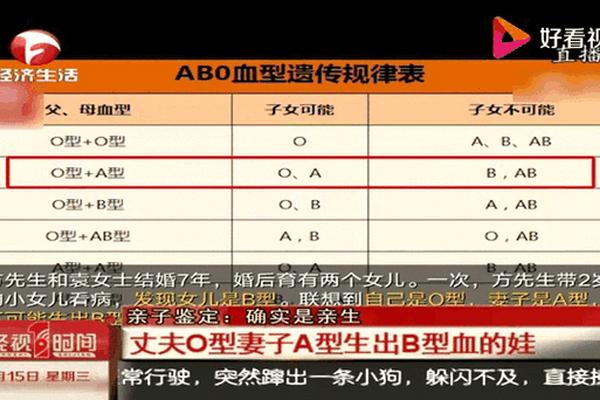
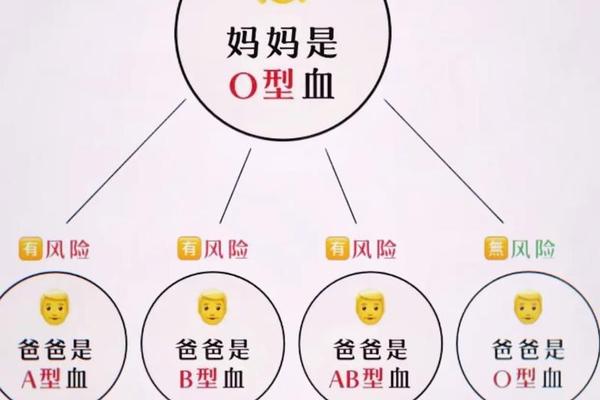
基因层面的罕见变异可能打破常规遗传规律。网页53报道的大连父女案例中,B(A)亚型源于GYPC基因c.797C>T点突变,使原本编码B抗原的基因异常表达出A抗原特征。这种嵌合型抗原现象解释了为何患者同时呈现A、B抗原与抗A抗体的矛盾血清学特征。此类变异挑战了传统的兰德斯特定律,为血型遗传研究开辟了新方向。
亚型识别技术的进步正不断揭示血型系统的多样性。网页18中鲁道宽案例最终确认为AB亚型,其抗原表达强度随健康状况波动,常规检测手段难以捕捉这种动态变化。类似案例在孟买型、类孟买型等稀有血型中更为常见,如网页49提及的"恐龙血"就存在抗原延迟表达特性,常规检测易误判为O型血。
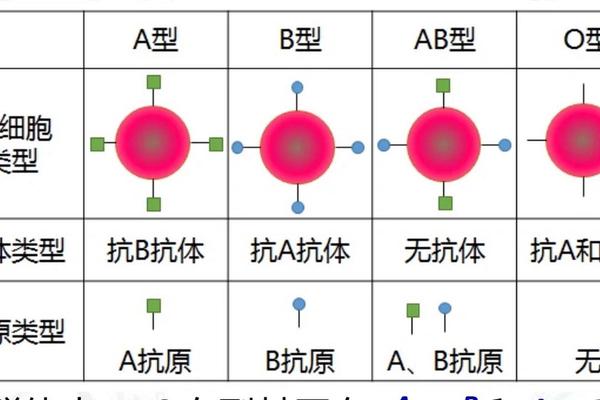
技术干预的前沿突破
酶工程技术为主动调控血型带来革命性突破。网页33介绍的嗜黏蛋白阿克曼菌酶制剂,可精准剪切B抗原末端的半乳糖分子,实现AB型向A型的定向转化。这种"分子剪刀"技术已在实验室实现90%以上的转化效率,其临床应用将极大缓解特殊血型短缺问题。丹麦团队更在此基础上研发出通用型O血制备技术,展现广阔应用前景。
器官移植领域的血型转换研究取得实质性进展。网页37披露的"常温灌注酶处理技术",通过向供体肾脏灌注特异性酶溶液,成功将B型器官转换为O型。该技术突破ABO血型屏障,使移植匹配率提升40%,为血型变异患者带来新希望。这种离体处理方式避免了受体免疫系统负担,开创器官移植新范式。
临床应对的系统重构
血型变异对输血安全提出严峻挑战。网页12所述案例中,患者输入原血型血液后引发溶血反应,直接威胁生命。这要求临床建立动态血型监测机制,对创伤、肿瘤、移植患者实施周期性抗原检测。日本国立血液中心已开发快速抗原定量检测芯片,可在10分钟内完成32种血型抗原的精准分析。
特殊血型库建设迫在眉睫。网页50建议自体血预存方案,但实际操作中面临保存时限与成本限制。深圳血液中心创新采用液态氮气相保存技术,将稀有血型红细胞保存期延长至15年,同时建立全国联网的"血型变异预警系统",实现跨区域应急调配。这种"生物银行+智能物联"模式为血型变异患者构筑生命防线。
当我们凝视血型变异这面医学棱镜,看到的不仅是抗原分子的物理改变,更是生命系统复杂性的集中展现。从基因突变到表观调控,从被动观察到主动干预,人类正逐步揭开血型系统的层层面纱。未来研究应聚焦于建立动态血型评估体系、开发精准编辑技术、完善应急保障网络,使每个独特的生命个体都能在医疗进步中获得平等救治权利。在这场与生命密码的对话中,科学探索的边界正在不断拓展。