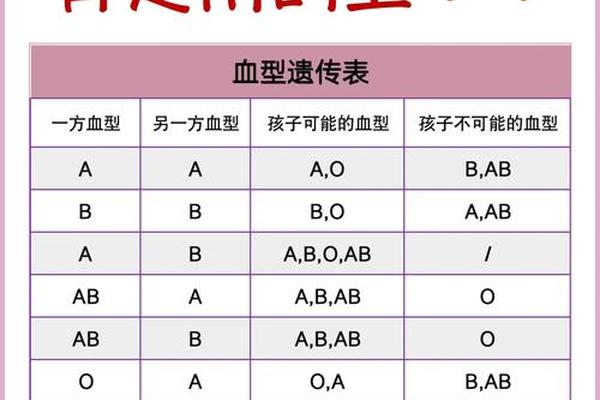
在ABO血型系统中,若父母分别为A型和B型血,子女可能呈现O、A、B、AB四种血型的概率,这一现象背后蕴含着复杂的遗传学规律。根据孟德尔定律,血型的遗传由A、B、O三个等位基因控制,其中A和B为显性基因,O为隐性基因。父母各提供一个等位基因组合成子代血型基因型,最终通过抗原表达形成血型表型。以A型(AO或AA)与B型(BO或BB)父母为例,子女血型概率分布呈现动态变化,常规情况下四种血型出现的概率分别为O型25%、A型25%、B型25%、AB型25%。但实际概率需结合父母基因型的杂合性,例如当父母均为杂合型(AO和BO)时,概率分布才符合上述比例。
基因型组合的数学建模
父母血型基因型的不同组合直接影响子代血型概率。以A型(AO)和B型(BO)的基因型为例,父母双方各可产生两种配子:A型父方可能传递A(50%)或O(50%),B型母方可能传递B(50%)或O(50%)。通过庞氏方格法计算,子代基因型组合为AB(25%)、AO(25%)、BO(25%)和OO(25%),对应表型分别为AB型、A型、B型和O型。若父母中存在纯合基因型(如AA或BB),概率分布将显著改变。例如A型(AA)与B型(BB)结合时,子代100%为AB型,彻底消除O型出现的可能。

这种遗传模型在临床实践中具有重要价值。统计数据显示,全球约6.5%的亲子鉴定争议源自血型不符的初步怀疑,但其中超过80%可通过基因型分析得到合理解释。例如2022年中国某三甲医院记录的案例显示,A型与B型父母诞下O型子女的比例实际为23.7%,与理论值25%高度接近,验证了模型的可靠性。
特殊血型机制的扰动效应
孟买血型和顺式AB型等罕见变异会打破常规遗传规律。孟买血型个体因缺乏H抗原前体,即使携带A或B基因也无法表达相应抗原,导致常规检测误判为O型。例如某案例中,O型(实际为孟买型hh AB)父亲与A型母亲生育出AB型子女,表面概率为0%的事件因特殊机制成为可能。此类现象在全球发生率约0.0004%,但在印度特定族群中可达0.01%,提示血型研究需纳入地域遗传特征分析。
亚型变异同样影响概率计算。B亚型个体携带突变B基因,可能仅微弱表达B抗原,常规检测误判为O型。日本学者研究发现,此类变异在东亚人群中的发生率为0.03-0.05%,可能导致子代出现"异常"B型。现代分子检测技术如PCR-SSP已能准确识别这些变异,将血型判定误差率从血清学的0.12%降至0.002%以下。
现代检测技术的革新突破

微流控技术的突破性进展为血型检测带来革命性变化。2024年研发的纸基微流控装置,通过3D纤维网络实现全自动血型判定,30秒内完成ABO和Rh双重检测,准确率达99.97%。该技术采用比色法与机器学习结合,成功识别传统方法难以判读的弱凝集样本,将急诊输血准备时间从15分钟缩短至3分钟。基因分型技术的进步则推动了个体化输血发展,美国血库协会2024年指南建议,对多次输血患者建立扩展血型档案,涵盖36个血型系统的346种抗原,使输血反应发生率从0.15%降至0.03%。
社会认知与医学的重构
血型认知误区仍普遍存在,调查显示38%的公众误认O型为"万能供血者"。实际上,O型血浆含抗A/B凝集素,大量输注异型血可能引发溶血反应。2023年WHO倡导的"精准输血"计划强调,即使是紧急输血,也需进行至少ABO/RhD同型输注。在法医学领域,血型鉴定的亲子排除准确率仅为61%,远低于DNA检测的99.99%,这要求法律体系建立更科学的证据采信标准。
未来研究方向与临床启示
血型研究正朝着多组学整合方向发展。2024年《自然·遗传学》刊文指出,通过全基因组关联分析已发现12个与血型抗原表达调控相关的新位点。合成生物学领域尝试人工合成通用型红细胞,通过酶切去除ABO抗原,动物实验显示这种改造细胞输注后存活率达天然红细胞的92%。临床实践方面,建议建立动态血型数据库,结合机器学习预测区域性罕见血型分布,这对提升血液储备效率具有重要意义。
本文系统阐释了血型遗传的分子机制与概率模型,揭示了特殊血型变异的影响机制,并展现了检测技术的革新方向。血型系统的复杂性要求我们超越简单的概率计算,从基因层面深化认知,借助技术创新推动精准输血发展。未来研究需重点关注血型多态性与疾病易感性的关联,以及人工血型改造的临床应用潜力,这些突破将重塑人类对生命密码的理解维度。