在人类对生命奥秘的探索历程中,ABO血型系统始终闪耀着独特的光芒。1900年,奥地利学者卡尔·兰德施泰纳首次发现A、B、O三种血型,这项突破性研究不仅为安全输血奠定基础,更开启了人类对血型与生命健康关系的研究篇章。作为ABO血型系统中的两极,O型血和A型血展现出截然不同的生物学特性——O型红细胞表面缺乏A/B抗原,而A型血则携带着决定性的A抗原,这种微观结构的差异如同生命密码般深刻影响着疾病易感性、遗传规律乃至公共卫生策略。
血型结构的分子密码
在红细胞膜表面,糖蛋白构成的抗原如同生物识别码般精密。A型血的红细胞表面存在N-乙酰半乳糖胺修饰的H抗原,这种糖基化修饰由α-1,3N-乙酰氨基半乳糖转移酶催化完成,形成独特的A抗原决定簇。而O型血则因基因突变导致转移酶失活,仅保留最原始的H抗原结构。这种分子层面的差异直接决定了两种血型的血清学特征:A型血清中含抗B抗体,O型血清则同时存在抗A和抗B抗体。
近年研究揭示,H抗原的糖链长度与拓扑结构对病原体识别具有重要影响。例如新冠病毒的S蛋白与ACE2受体结合过程中,A型血的N-乙酰半乳糖胺修饰可能增强病毒吸附效率,这解释了流行病学统计中A型血人群感染率更高的现象。而O型血的H抗原表面缺乏额外修饰,可能形成空间位阻效应,降低病毒入侵效率。
遗传编码的生命图景
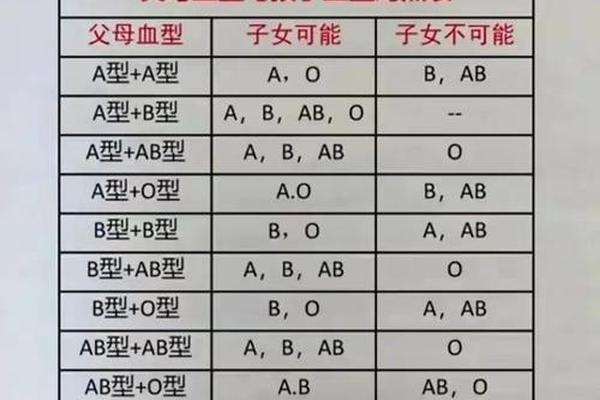
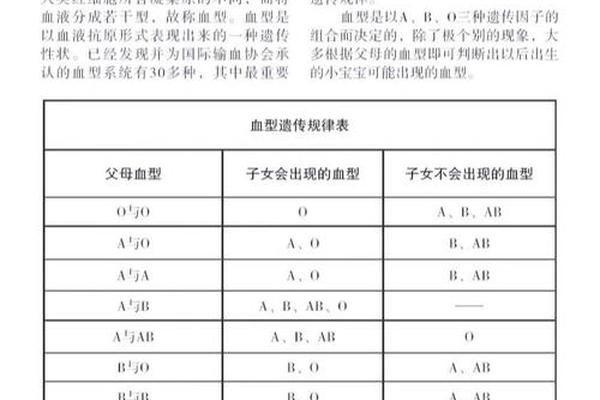
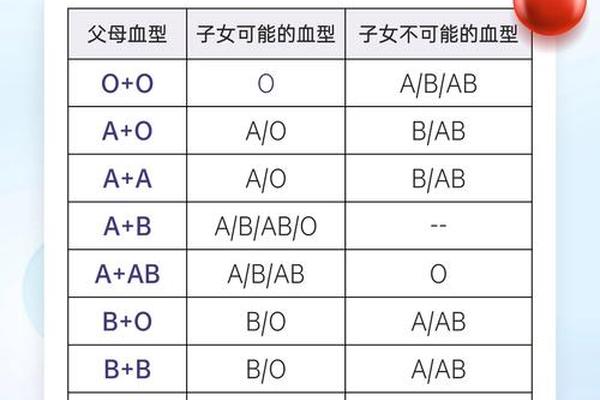
血型遗传遵循孟德尔定律,却展现出复杂的显隐关系。A型血的基因型可以是AA或AO,其中A为显性基因;O型血则必须继承父母双方隐性O基因,表现为纯合子ii。这种遗传机制导致血型分布呈现显著地域差异——全球O型血占比约44%,而东亚地区A型血比例高达31%。
家系研究揭示出惊人的遗传现象:当父母均为AO型时,子代有25%概率继承OO基因型成为O型血。这种隐性遗传特性曾引发诸多家庭误解,如2020年深圳某医院收治的新生儿出现"父母O型却生育B型婴儿"的案例,最终通过基因测序发现母亲携带罕见的CisAB型基因,其AB抗原共表达于同一染色体。这类特殊遗传现象提示临床需建立更精准的血型检测体系。
健康风险的差异化表达
血型抗原与疾病的关联性研究持续刷新医学认知。大规模队列研究表明,A型血人群纤维蛋白原水平较O型血高12%,血小板聚集活性增强18%,这与其心脑血管疾病风险升高直接相关。2019年《柳叶刀》发表的20万人群数据显示,A型血个体罹患胃癌的风险较O型血增加20%,可能与幽门螺杆菌对A抗原的特异性识别有关。
O型血虽在多数慢性病中表现优势,但其胃酸分泌量较其他血型高30%,导致消化性溃疡发病率增加2.4倍。这种矛盾性在新冠研究中尤为突出:2020年《新英格兰医学杂志》证实O型血人群感染后重症风险降低35%,但其疫苗抗体应答强度却弱于A型血群体,这可能与天然抗体的免疫调节作用相关。
临床应用的革新突破
在输血医学领域,O型血的"万能供体"地位正面临科学审视。传统认知认为O型红细胞缺乏A/B抗原可安全输注,但其血浆中的抗A/B抗体仍可能引发溶血反应。现代输血规范要求进行交叉配型,并将输注量控制在红细胞悬液范畴。2024年《自然·微生物学》报道的突破性研究显示,从嗜黏蛋白阿克曼菌中提取的糖苷酶可有效清除A/B抗原,使转化后的红细胞具备O型血特性,该技术使血液转化效率提升至98.7%。
基因编辑技术为血型改造提供新思路。科学家利用CRISPR-Cas9系统敲除H抗原合成相关基因,成功将诱导多能干细胞分化为O型红细胞。这类人工血细胞已完成灵长类动物实验,其携氧能力与天然红细胞相当,为稀有血型储备开辟全新路径。
从分子结构的精巧设计到疾病风险的动态平衡,O型血与A型血的生物学差异诠释着生命系统的复杂性与适应性。现有研究证实,血型抗原不仅是简单的遗传标记,更是连接先天免疫、病原进化和个体化医疗的重要枢纽。未来研究需在三个维度深化:建立多组学血型数据库解析基因-环境互作机制,开发抗原编辑技术实现精准血液改造,探索血型特异性药物代谢规律。正如诺贝尔奖得主兰德施泰纳所言:"血液中的密码,终将指引人类揭开生命保护的神秘面纱。