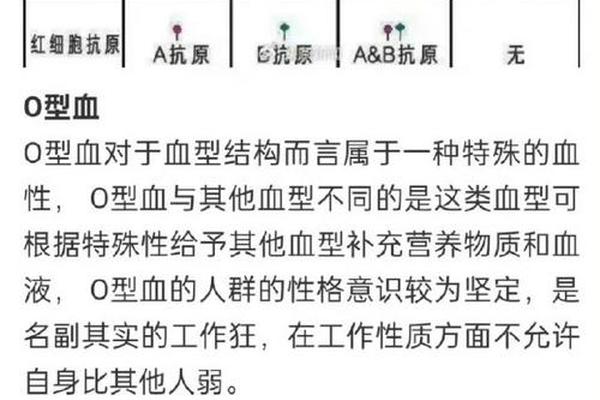
人类血型系统是血液中红细胞表面抗原差异形成的生物学标记,其分类依据主要基于ABO和Rh两大核心系统。其中"A+"或"A-"这类符号中的字母代表ABO血型系统中的A型,而"+"或"-"则对应Rh血型系统的阴阳性划分。A型血指红细胞表面携带A抗原,血浆中含抗B抗体;Rh阳性表示红细胞存在Rh(D)抗原,阴性则缺乏该抗原。
ABO血型系统的发现可追溯至1900年,奥地利学者兰德施泰纳通过血清凝集实验首次揭示血液的抗原差异。该系统的基因位点位于9号染色体,由IA、IB、i三个等位基因控制,A型个体的基因型可能是IAIA或IAi。Rh系统则因恒河猴实验得名,其D抗原的存在与否直接决定Rh阴阳性,该性状由1号染色体上的RHD基因控制。这两个系统的组合形成"A+""A-"等完整血型表述,全球约35.7%的亚洲人口为A型,其中Rh阴性占比不足1%。
遗传规律与亲子关系判定
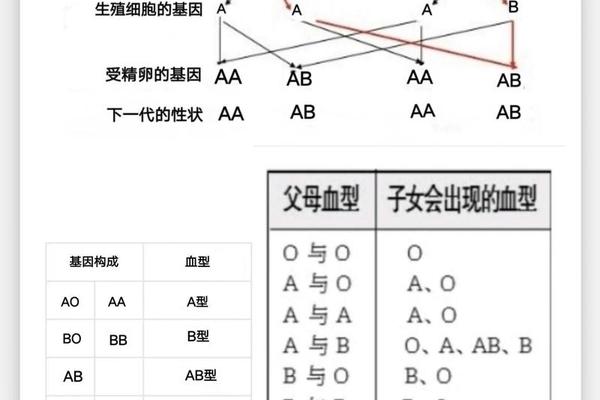
ABO与Rh血型均遵循孟德尔遗传定律。A型父母若携带隐性i基因(如IAi型),子代可能遗传i基因形成O型血。Rh阴性属于隐性遗传,只有当父母双方均传递隐性基因时,子女才会表现为Rh阴性。例如A+血型(基因型IAIA或IAi,RHD阳性)与A-血型(IAIA或IAi,RHD阴性)结合,子代Rh阴性概率取决于父母RHD基因的携带情况。
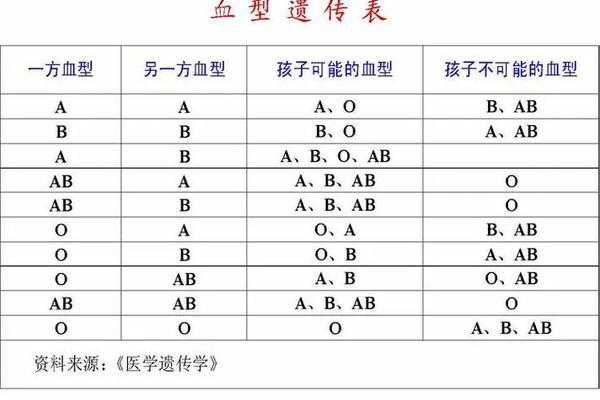
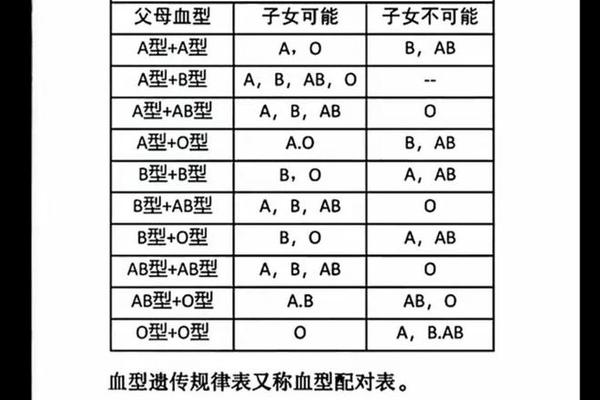
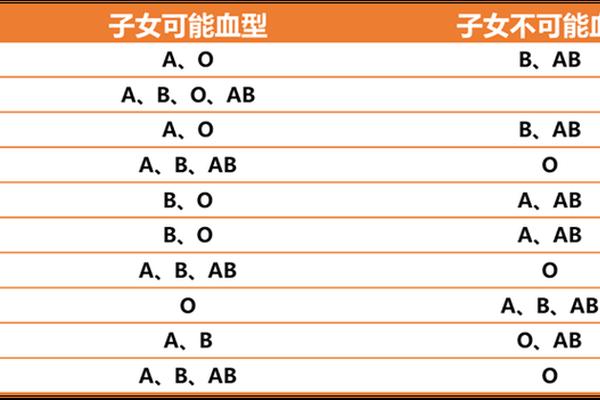
临床实践中,血型遗传规律常用于亲子关系初步筛查。若父母均为O型,子女不可能出现AB型;A型与B型结合可能孕育所有血型子代。但需注意,基因突变、嵌合体等特殊情况可能打破常规遗传规律,此时需依赖DNA检测确认。近年研究还发现,MN、Duffy等稀有血型系统也可能影响亲子鉴定结论,如Duffy血型抗原缺失会导致特殊抗体产生。
临床输血与免疫反应机制
A+与A-血型的临床差异主要体现在输血相容性。A+个体可接受A+、A-、O+、O-型血液,而A-受血者只能接受A-和O-型,因Rh阴性者输入Rh阳性血会产生抗D抗体。这种免疫记忆效应可能引发二次输血时的溶血反应,严重者可导致肾衰竭。统计显示,我国Rh阴性血型者仅占0.3%-0.4%,建立稀有血型库成为保障用血安全的关键措施。
新生儿溶血病是另一重要临床问题。当Rh阴性母亲孕育Rh阳性胎儿时,胎儿的D抗原可能刺激母体产生IgG抗体,这些抗体透过胎盘引发胎儿红细胞溶解。首胎通常不受影响,但次胎患病风险显著增加,需通过产前抗体筛查和产后免疫球蛋白注射进行干预。2023年报道的MN血型不合导致反复胎死案例,更凸显稀有血型系统检测的重要性。
社会支持与罕见血型管理
建立动态更新的稀有血型数据库是解决临床用血困境的核心方案。以上海为例,血站通过基因分型技术已建档2,000余例稀有血型捐献者,响应时间缩短至4小时。2024年某骨科手术案例显示,Fya抗原阴性血液的跨省调配成功挽救了抗-Fya抗体患者的生命,这得益于全国血站联盟的信息共享机制。
公众教育同样不可或缺。建议所有育龄夫妇进行扩展血型筛查,特别是家族中有流产史或输血史者。对于已确认为Rh阴性的个体,建议定期参与献血者登记,并冷冻储存自体血液以备手术急需。日本学者提出的"血浆置换+免疫抑制"联合疗法,为高抗体效价孕妇提供了新的治疗思路。
未来研究方向与技术突破
基因编辑技术为血型转化带来可能。2023年《自然》杂志报道,通过CRISPR-Cas9敲除HEK293细胞中的ABO基因,成功实现O型红细胞的体外培育,该技术有望解决AB型血浆短缺问题。人工智能在血型预测中的应用也取得进展,深度学习模型通过分析基因组数据,可提前预判新生儿稀有血型风险,准确率达92.3%。
合成生物学领域,科学家正尝试构建人工血型抗原。斯坦福大学团队利用糖基转移酶工程化改造,研发出通用型红细胞,这种细胞表面同时表达A、B抗原酶活性调节系统,能根据受体环境自动调整抗原表达。这类突破将彻底改变传统输血模式,推动个性化血液治疗的发展。
A+"与"A-"的符号差异背后,蕴含着复杂的免疫遗传学机制与临床风险管理体系。从ABO抗原的糖链结构到RhD蛋白的空间构象,从基因检测技术的精准化到跨区域血液调配网络的完善,每个环节都体现着医学进步对人类生命的尊重。建议医疗机构将扩展血型筛查纳入常规体检,科研机构加强血型转化技术攻关,公众则需提升血型认知,共同构建更安全的血液保障生态。未来,随着单细胞测序和类器官技术的发展,个体化血液制品制备或将开启输血医学的新纪元。