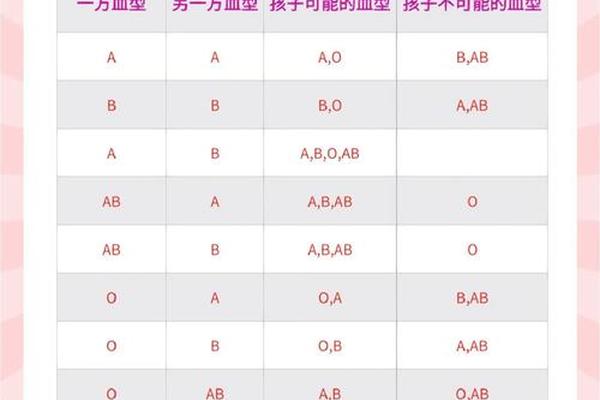
贫血作为全球最常见的血液疾病,其不同类型在发病机制和社会影响层面呈现显著差异。缺铁性贫血(缺血型a贫血)与α-地中海贫血分别代表了营养代谢异常和遗传性血红蛋白病的两大典型,前者影响着全球约20%的人口,后者在东南亚地区的携带率高达10%。两类疾病虽均以贫血为核心表现,但其病因学、诊疗策略及社会干预模式存在本质差异,需要从分子机制到临床实践进行系统性解析。
病因学的根本分野
缺铁性贫血的本质是铁代谢失衡。当机体铁储备低于6-8mg/kg时,血红素合成受阻,导致血红蛋白浓度下降。这种失衡常源于饮食摄入不足(如素食者日均铁摄入量仅1.8mg)、慢性失血(女性月均铁丢失量达30mg)或吸收障碍(胃酸缺乏使铁吸收率下降50%)。值得注意的是,妊娠期女性铁需求激增至7.5mg/天,是普通成人的3倍,这使得该群体发病率高达41%。
α-地中海贫血则源于16号染色体上的α珠蛋白基因簇突变。每个二倍体细胞携带4个α基因,当缺失数量≥3时即出现临床症状。东南亚常见的右侧缺失(3.7kb)导致α+型,而4.2kb左侧缺失则引发α0型。非缺失型突变中,Constant Spring突变占中国病例的35%,其产生的异常α链使红细胞寿命缩短至正常值的1/3。这种基因剂量效应决定了疾病严重程度:从无症状的静止型到致死性的Hb Bart's胎儿水肿综合征。
临床表现的谱系差异
缺铁性贫血呈现渐进性代偿特征。早期表现为运动耐力下降和异食癖,当血红蛋白<80g/L时出现匙状甲和吞咽困难。实验室检查中,血清铁蛋白<15μg/L具有97%的诊断特异性,而铁染色阴性是金标准。值得关注的是,慢性病患者常合并功能性缺铁,其铁调素水平升高可抑制肠道铁吸收。
α-地中海贫血的临床表现呈现基因型-表型对应关系。中间型HbH病患者血红蛋白维持在70-100g/L,但氧化应激可诱发溶血危象,使胆红素水平骤升3倍。胎儿水肿综合征的胎盘重量可达正常4倍,超声显示特征性的"太空人征"——胎儿因严重腹水呈现四肢悬垂姿态。最新研究显示,HbH包涵体引发的膜脂质过氧化是红细胞破坏的核心机制。

治疗策略的革新路径
缺铁性贫血的标准治疗正在发生范式转变。传统口服铁剂因胃肠道副作用使30%患者依从性差,新型羧基麦芽糖铁静脉制剂可在单次输注后补充1000mg铁元素。对于炎症性肠病患者,联合hepcidin抑制剂可突破铁调素阻滞,使铁利用率提升40%。
α-地中海贫血的精准治疗进入基因编辑时代。武汉大学团队开发的tBE碱基编辑器,通过靶向修饰HBG启动子的BCL11A结合域,使γ-珠蛋白表达量提升8倍,且脱靶率低于0.01%。该技术已完成首例临床试验,患者输血间隔从2周延长至6个月。对于重型患者,异基因造血干细胞移植的5年生存率现已达87%,但GVHD发生率仍待改善。
公共卫生干预的立体架构
在预防层面,缺铁性贫血需要多维干预。澳大利亚实施的食品铁强化计划使育龄妇女贫血率下降18%,而可降解铁螯合剂的应用使补铁效率提升3倍。智能穿戴设备通过监测心率变异系数,可实现贫血的早期预警。
针对α-地中海贫血,南方地区已建立三级防控体系:婚前筛查识别携带者,绒毛膜穿刺实现孕早期诊断,新生儿足跟血筛查使确诊时间提前至出生72小时。广东实施的-保险-慈善联合支付模式,使重型患者年均治疗费用从12万元降至3万元。
未来发展的交叉前沿
在基础研究领域,铁死亡机制与地中海贫血的相关性成为热点。清华大学团队发现,HbH病患者红细胞谷胱甘肽过氧化物酶4(GPX4)活性下降60%,提示铁死亡抑制剂可能成为新型治疗靶点。人工智能辅助的基因编辑设计平台,可使HBG启动子修饰效率预测准确率达92%。
临床转化方面,器官芯片技术正在革新药物评价体系。哈佛大学开发的-on-chip模型,可实时观察α-珠蛋白异常红细胞穿过脾窦的动态过程,为药物筛选提供可视化平台。这些突破标志着贫血诊疗正在向精准化、个体化方向跨越式发展。
从铁代谢调控到基因编辑修复,两类贫血的研究进展体现了现代医学的多维突破。缺铁性贫血的防治需要建立营养-医疗-技术的协同网络,而α-地中海贫血的根治之路在于基因疗法的安全性和可及性提升。未来研究应聚焦于:①开发跨膜铁转运增强剂;②优化碱基编辑器的递送系统;③建立区域性血红蛋白病全程管理云平台。只有将基础发现转化为临床实践,才能实现"健康中国2030"的贫血防控目标。