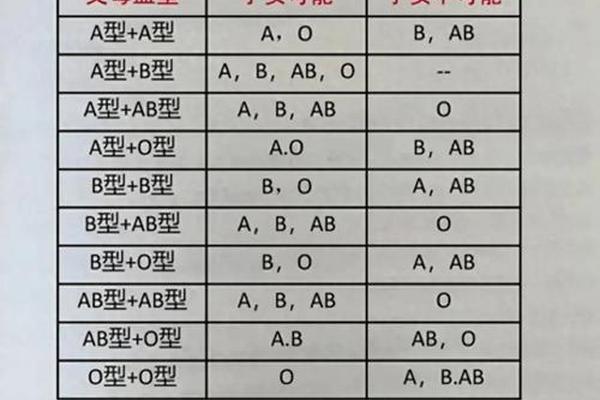
血液中的ABO抗原标记不仅是输血配型的核心依据,更在医学研究中展现出与癌症风险的神秘关联。自1953年英国学者首次发现A型血与胃癌的统计学联系以来,全球科学家在跨越半个世纪的追踪研究中不断验证着这一现象的稳定性。2022年《神经学》杂志披露,A型血人群在60岁前的中风风险较其他血型高出16%,而上海交通大学团队对18000人长达25年的队列研究更揭示,A型血人群整体患癌风险较非A型血人群提升12%。这种看似宿命论的统计学差异,正推动着医学界对癌症发生机制的深层探索。

一、消化道癌症的显著关联
在胃癌研究领域,A型血展现出惊人的易感性特征。上海瑞金医院2012年对1000余例胃癌患者的分析显示,A型血患者比例超出普通人群34%,这一发现在台湾地区2015年的研究中得到强化——A型血人群胃癌患病与死亡风险同步提升38%。上海交通大学团队25年追踪数据更具体指出,A型血人群胃癌发病风险较非A型血提升20%,结直肠癌风险亦呈现相似增幅。全球24项研究、超万名胃癌患者的荟萃分析同样证实,A型血人群胃癌风险增加11%。
这种地域跨越性的风险一致性暗示着生物学基础的存在。日本学者发现A型血人群幽门螺杆菌感染率显著高于其他血型,而该菌种已被WHO列为I类致癌物。但矛盾的是,中国研究发现O型血人群幽门螺杆菌感染率最高却胃癌风险最低,这种生物学悖论将研究视线引向更深层的免疫机制。美国国立癌症研究所的动物实验显示,A抗原与胃癌细胞表面黏附分子的结构相似性,可能削弱机体免疫识别能力。
二、生物学机制的探索
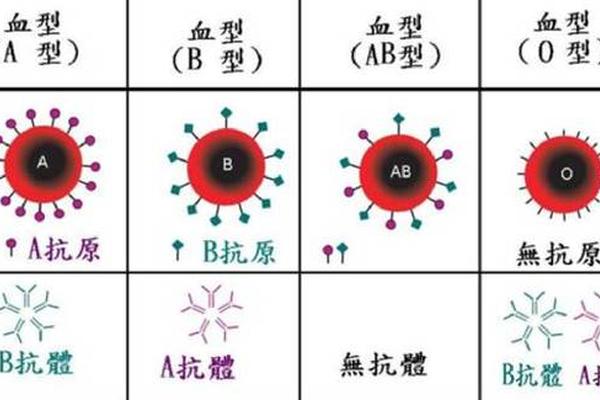
血型抗原对免疫系统的调控作用成为解释癌症易感性的关键。O型血个体天然携带抗A、抗B两种抗体,而A型血仅存抗B抗体。当肿瘤细胞表面抗原模拟A型抗原时,A型血个体缺乏对应抗体进行清除,这种免疫监视的漏洞在癌研究中得到印证——O型血人群癌风险降低25%。北京大学团队通过基因编辑技术证实,ABO基因座单核苷酸多态性可改变T细胞受体信号通路活性。
炎症反应调控是另一重要通路。A型抗原可增强IL-6、TNF-α等促炎因子表达,这种慢性炎症环境为癌细胞增殖提供沃土。上海肿瘤研究所的分子动力学模拟显示,A抗原糖基化修饰改变细胞间黏附力,使消化道黏膜更易受致癌物侵蚀。值得注意的是,这种机制具有组织特异性,在肝癌中A型血反而显现保护作用,其机制可能与肝脏特有的免疫微环境相关。
三、风险与保护的矛盾性
在消化系统之外的癌症谱系中,A型血展现出复杂的风险图谱。乳腺癌领域存在显著性别差异,A型血女性患病风险提升12%,而男性未见明显关联。这种差异可能源于雌激素代谢产物与A抗原的相互作用,上海妇产科医院团队发现A型血女性芳香化酶活性较其他血型高18%。但在肺癌研究中,A型血未显示显著风险提升,这可能与呼吸道黏膜ABO抗原表达模式不同有关。
矛盾性在肝癌研究中尤为突出。上海队列数据显示A型血人群肝细胞癌风险降低15%,台湾地区研究更发现其肝癌死亡率较其他血型低22%。这种保护效应可能与肝脏特有的枯否细胞清除机制相关,动物实验显示A型抗原可增强枯否细胞对癌前病变细胞的吞噬效率。但在胆管癌领域,A型血风险又回升至普通人群的1.3倍,提示肝胆系统癌症风险的器官特异性。
四、预防策略的再思考
面对A型血的癌症易感性,精准预防策略需突破血型决定论的局限。解放军总医院建议A型血人群将胃镜检查年龄提前至35岁,检查频率增加至每2年1次。在生活方式干预方面,韩国国立癌症中心研究发现,A型血人群摄入全谷物可使胃癌风险降低37%,这种保护效应在其他血型中仅为21%。基因检测技术的进步为个体化预防提供新路径,ABO基因分型联合PGⅠ/PGⅡ比值检测,可使早期胃癌检出率提升至89%。
值得注意的是,血型风险存在代偿机制。上海营养研究所的队列研究显示,A型血人群维持维生素D水平>30ng/ml时,结直肠癌风险差异完全消失。这种环境因素与遗传特征的交互作用,为癌症预防开辟新思路。目前正在进行的国际多中心试验NCT04879276,正在评估靶向ABO抗原的免疫调节剂在A型血高危人群中的应用价值。
在癌症发生的复杂网络中,A型血如同一个特殊的生物标记,既非命运判决书,也非无关参数。现有证据表明,其12%的整体风险增幅远低于吸烟(提升500%肺癌风险)或HPV感染(提升200倍宫颈癌风险)。医学界正在构建的血型-基因-环境三维风险模型,将帮助个体在了解先天脆弱性的通过后天干预重塑健康轨迹。正如《自然·遗传学》最新述评指出:“ABO抗原系统为理解癌症生物学打开新窗口,其临床价值的深度挖掘需要跨学科、多组学的协同创新”。