ABO血型系统作为人类最早发现的血液分型体系,其核心在于红细胞表面A、B抗原的分布以及血清中抗A、抗B抗体的互补存在。其中,抗A抗体作为A型血血清中的标志性成分,是血型鉴定与输血安全的核心研究对象。通过ABO血型鉴A型的过程,不仅能明确个体血液特征,更是临床输血、器官移植、遗传学研究的重要依据。本文将从生物学机制、检测技术、临床应用及研究挑战等多个维度,系统解析抗A抗体的科学内涵与鉴A型技术的实践价值。
一、ABO血型系统的生物学基础
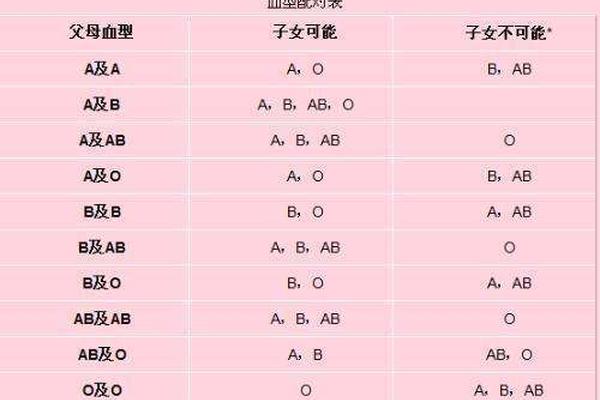
A型血的红细胞表面携带A抗原,其本质是由H抗原经α-1,3-N-乙酰半乳糖胺转移酶催化形成的糖链结构。该酶由位于9号染色体的IA基因编码,其催化作用将N-乙酰半乳糖胺连接到H抗原的β-D-半乳糖末端,形成A抗原的独特表位。这种抗原的表达具有显性遗传特征,父母中任一方的IA基因均可导致子代表现为A型或AB型。
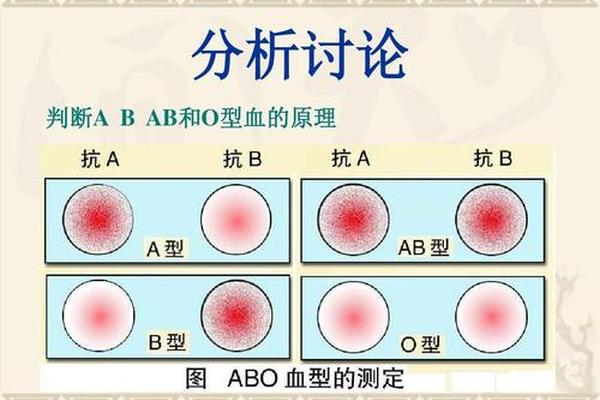
抗A抗体则属于IgM类免疫球蛋白,在出生后6-12个月内通过环境微生物的交叉抗原刺激自然产生。其与A抗原的结合可激活补体系统,引发红细胞溶解反应。值得注意的是,A型血清中仅存在抗B抗体,而AB型个体因同时携带A、B抗原,血清中不含有抗A或抗B抗体。这种抗原-抗体的互补关系,构成了ABO血型鉴定的理论基础。
二、抗A抗体的检测方法学演进
传统的玻片法通过将抗A标准血清与待检红细胞悬液混合,观察凝集现象判断血型。该方法操作简便,但受环境温度、抗体效价影响显著,对亚型抗原敏感性不足,仅适用于大规模初筛。例如A2亚型因抗原表位数量较少,在玻片法中可能呈现弱凝集,需延长观察时间至15分钟以上以避免假阴性。
试管法则通过离心加速抗原-抗体反应,显著提高检测灵敏度。研究显示,离心力1000r/min条件下,仅需1分钟即可完成凝集判定,对老年患者或抗原减弱的病理状态更具诊断价值。现代凝胶微柱法进一步实现标准化操作,利用葡聚糖凝胶的分子筛效应,使凝集细胞滞留于胶体上层,非凝集细胞沉降至管底,通过自动化仪器判读结果,误差率可控制在0.01%以下。
三、临床实践中的双重意义
在输血医学领域,准确鉴A型是避免溶血反应的首要防线。统计显示,ABO血型不合输血导致的急性溶血死亡率高达40%,而抗A抗体与供体A型红细胞的结合正是主要诱因。对于O型血供者,虽然其红细胞缺乏A、B抗原,但血清中的抗A抗体在大量输血时仍需通过洗涤去除,以防止受血者红细胞被破坏。
器官移植领域同样依赖精准血型匹配。研究发现,肾移植中ABO血型不符会导致超急性排斥反应,其机制与血管内皮细胞表面A抗原引发的抗体介导损伤密切相关。近年来开展的抗原修饰技术,如使用α-半乳糖苷酶清除移植物表面A抗原,为跨血型移植提供了新思路,但临床转化仍需进一步验证。
四、技术挑战与研究前沿
疾病状态下的血型变异给鉴A型带来特殊挑战。白血病患者中,约0.3%病例出现A抗原表达减弱甚至消失,这与红系造血受抑导致糖基转移酶活性下降有关。类B现象(获得性B抗原)可能误判血型,需通过酸处理去除细菌酶修饰的假性抗原后再行检测。
基因检测技术的突破为精准分型开辟新路径。通过PCR-SSP法检测ABO基因第6、7外显子序列,可鉴别常规血清学无法区分的A亚型,如A3、Ax等。纳米孔测序技术更可实现单倍体型分析,对嵌合体、移植后血型转换的监测具有独特优势。
五、未来发展方向
抗体工程领域,重组抗A单克隆抗体的研发正推动检测试剂标准化。通过噬菌体展示技术筛选高亲和力抗体片段,可使试剂效价提升至1:512,显著增强对弱A亚型的识别能力。人工智能辅助判读系统则通过深度学习凝集模式,将玻片法的准确率从92%提升至98.7%,尤其在混合视野判别中展现优势。
在血型改造方面,CRISPR/Cas9基因编辑技术已成功敲除造血干细胞ABO基因,制备通用型O型红细胞。2024年临床试验显示,编辑后细胞存活率超90%,为缓解稀有血型短缺提供革命性方案。
抗A抗体的生物学特性与鉴A型技术的精进,深刻影响着现代医学的发展轨迹。从经典的血清凝集试验到分子水平的基因解析,技术创新不断突破血型研究的边界。未来,随着合成生物学与人工智能的深度融合,血型检测将迈向更高精度与智能化,为个性化输血治疗、跨血型器官移植等临床难题提供更优解决方案。建议进一步加强血型数据库建设,完善罕见亚型检测标准,推动多学科交叉研究,最终实现精准血液医疗的全面升级。